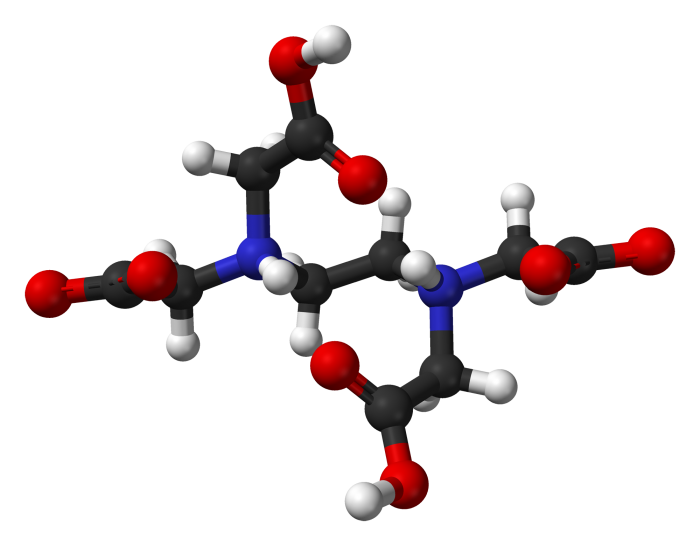
Acido etilendiamminotetraacetico (EDTA): Struttura e proprietà
L’EDTA, conosciuto anche come acido etilendiamminotetraacetico, è un acido poli amminocarbossilico incolore e solubile in acqua. La sua base coniugata è l’etilendiamminotetracetato, un agente chelante esadentato che ha la capacità di “sequestrare” ioni metallici come Ca2+, Mg2+ e Fe3+.
L’EDTA è un agente chelante versatile in grado di formare quattro o sei legami con lo ione metallico ed è comunemente utilizzato nei saponi e nei detergenti per formare complessi sia con lo ione Ca2+ che con lo ione Mg2+ presenti nelle acque dure, prevenendone l’interferenza.
Equilibri e formazione dei complessi
L’EDTA dà luogo a quattro equilibri di dissociazione a causa dei quattro gruppi carbossilici in acqua, regolati da quattro costanti: pKa1 = 2.0, pKa2 = 2.67, pKa3 = 6.16 e pKa4 = 10.26. La forza e la stabilità dei complessi formati dipendono dal pH dell’ambiente.
L’equazione generale per la formazione di un complesso 1:1 è M + Y ⇄ MY, dove M è lo ione metallico e Y è l’agente chelante. La costante di formazione è data da K = [MY]/[M][Y]. Grazie alla sua struttura, l’EDTA, con i suoi gruppi carbossilati e amminici, forma complessi particolarmente stabili a forma di gabbia.
Siti di coordinazione e proprietà acide
Il numero dei siti di coordinazione dipende dalle dimensioni dello ione metallico. Oltre alle proprietà di legante, l’EDTA è anche un acido debole: la forma totalmente protonata dell’EDTA è un acido debole esaprotico con specifici valori di pKa. Da tali valori si evince che Y4- diventa la forma predominante a valori di pH maggiori di 10.17.
In conclusione, l’EDTA svolge un ruolo cruciale nei processi di chelazione e nella formazione di complessi metallici, mostrando proprietà e equilibri interessanti dalle implicazioni pratiche importanti.