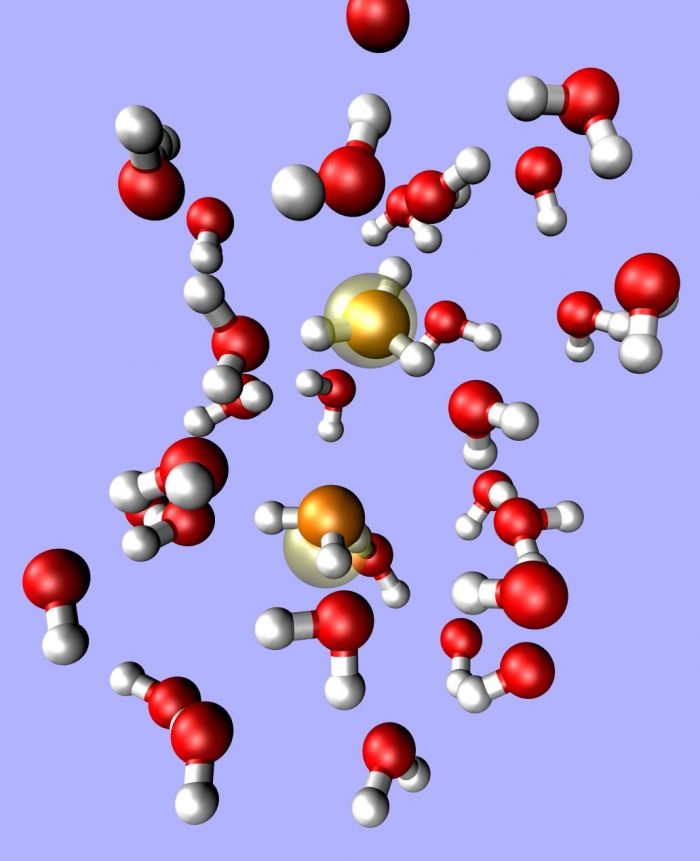
Acquoioni: Le Componenti della Sfera di Idratazione
Nei processi chimici, i cationi e gli anioni si legano a un numero specifico di molecole d’acqua, dando origine a specie idrate chiamate acquoioni. Questo legame è chiamato numero di idratazione e determina l’organizzazione delle molecole d’acqua attorno alla specie in questione.
Le molecole d’acqua agiscono in modo specifico rispetto alle specie presenti in soluzione. Ad esempio, lo ione Cr³⁺ interagisce con sei molecole d’acqua disposte ai vertici di un ottaedro. Questo complesso di molecole d’acqua è noto come prima sfera di idratazione.
Inoltre, ciascuna di queste molecole può legarsi ad altre molecole di solvente attraverso legami a idrogeno, formando così una seconda sfera di idratazione. È importante notare che il numero esatto di molecole in questa seconda sfera non può essere determinato con precisione, ma si sa che sono legate meno saldamente rispetto a quelle della prima sfera.
Tutti i cationi presenti in soluzione sono idratati, e per molti di essi, come Ni²⁺, Fe²⁺, Co³⁺, Mg²⁺, la prima sfera di idratazione forma un ottaedro (con numero di idratazione uguale a sei). Altri cationi, come K⁺, Be²⁺, presentano quattro molecole nella prima sfera di idratazione, probabilmente disposte ai vertici di un tetraedro.
Allo stesso modo, anche gli anioni sono idratati e formano una prima e una seconda sfera di idratazione. Le molecole d’acqua si dispongono verso l’ione negativo con la parte positiva del dipolo, ovvero dalla parte degli idrogeni.
Gli ioni idratati sono noti come acquoioni e si rappresentano con il numero di molecole d’acqua che li circonda o con il suffisso “aq”. Ad esempio, l’acquoione cobalto (III) può essere simboleggiato come [Co(H₂O)₆]³⁺ o Co³⁺(aq).
Acquoioni allo stato solido
Gli acquoioni possono esistere anche allo stato solido, come ad esempio i cationi dei sali. Il perclorato di nichel (II) esaidrato Ni(ClO₄)₂⋅ 6 H₂O presenta un reticolo cristallino costituito da acquoioni nichel [Ni(H₂O)₆]²⁺ e ioni perclorato ClO₄⁻. Un tipo particolare di acquoione è lo ione idrogeno, che, a causa della sua elevata densità di carica, interagisce fortemente con le molecole del solvente.
È stato dimostrato che molti acidi solidi idrati del tipo HX⋅ H₂O sono costituiti da H₃O⁺ e X⁻. L’ione H₃O⁺, detto ione ossonio, ha una geometria piramidale interpretabile in termini di ibridazione sp³ dell’atomo di ossigeno.
Calore di idratazione
I valori dei calori di idratazione di alcuni ioni gassosi a 25° evidenziano che l’energia dell’interazione ione-solvente cresce al crescere della carica elettrica e al diminuire del raggio dello ione. In generale, l’energia dell’interazione ione-solvente è influenzata anche dalle dimensioni dello ione.
Inoltre, si osserva che a parità di carica elettrica, il calore di idratazione diminuisce al crescere delle dimensioni dello ione. I confronti dei valori del calore di idratazione degli ioni metallici in funzione del raggio ionico mostrano che, a parità di carica elettrica, il calore di idratazione diminuisce al crescere delle dimensioni dello ione.
Ioni metallici contenenti elettroni d
Ioni metallici contenenti elettroni d mostrano ulteriori variazioni nella struttura dell’acqua a causa della stabilizzazione del campo cristallino. Questi ioni possono avere un effetto strutturante o destrutturante a seconda della loro dimensione e carica. In generale, ioni di piccole dimensioni e carica elevata tendono ad avere un effetto strutturante, mentre ioni di grosse dimensioni e piccola carica tendono ad avere un effetto destrutturante.