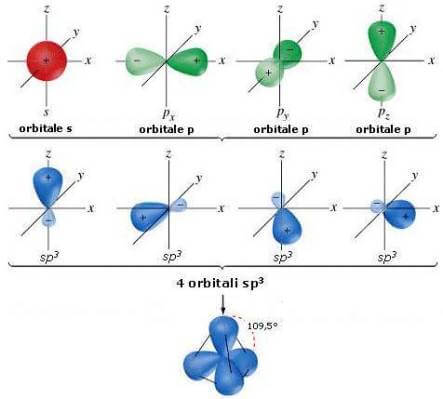
L’ibridazione sp3 e la sua relazione con la geometria molecolare
Quando un atomo ha un elettrone spaiato in un orbitale s e tre nell’orbitale p, si verifica l’ibridazione sp3. In questo processo, un elettrone appartenente all’orbitale s e tre elettroni appartenenti all’orbitale p formano 4 orbitali ibridi, ognuno dei quali contiene il 25% di carattere s e il 75% di carattere p. Un esempio comune di ibridazione sp3 è rappresentato dal metano.
Il carbonio, ad esempio, ha configurazione elettronica 1s2, 2s2, 2p2. Quando avviene l’ibridazione sp3, l’orbitale s e i tre orbitali p formano quattro orbitali identici per forma, dimensione e energia, che nel caso del metano si legano con altrettanti atomi di idrogeno formando legami con uguale lunghezza.
La geometria molecolare delle molecole con ibridazione sp3 segue la teoria VSEPR, secondo la quale gli orbitali tendono a disporsi il più lontano possibile tra loro per effetto della repulsione, seguendo la disposizione dei vertici di un tetraedro equilatero con angoli diedro di 109.5°.
Oltre al carbonio, anche gli elementi appartenenti al Gruppo 14, come il silano e il germano, possono presentare ibridazione sp3. Inoltre, elementi di gruppi diversi, come azoto e ossigeno, possono dare luogo a ibridazione sp3. Ad esempio, l’azoto può formare 4 orbitali ibridi sp3, di cui uno è occupato dal doppietto elettronico solitario, come nell’ammoniaca. Similmente, l’ossigeno può formare 4 orbitali ibridi sp3, di cui due sono occupati da doppietti elettronici solitari, come nell’acqua.
L’ibridazione sp3 è quindi un concetto fondamentale per comprendere la struttura e la geometria molecolare di diverse sostanze chimiche.
Per ulteriori informazioni sull’ibridazione sp3, consulta il seguente link: [chimica.generale/ibridazione-sp3](https://chimica.today/chimica-generale/ibridazione-sp3)