Il legame a idrogeno e la sua influenza sulla temperatura di ebollizione
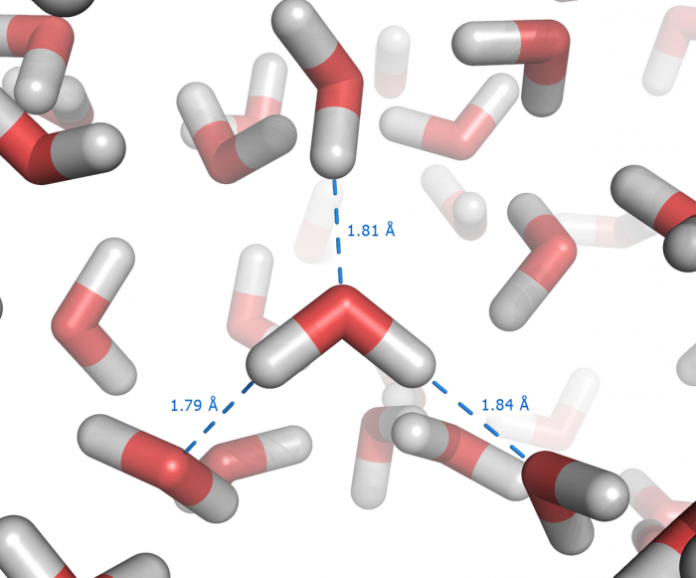
Il legame a idrogeno è un legame intermolecolare che si verifica quando un atomo di idrogeno è legato a un elemento elettronegativo e di piccole dimensioni come F, O e N. Questo tipo di legame intermolecolare è considerato il più forte dei legami secondari e influisce notevolmente sulle proprietà fisiche delle molecole in cui si verifica.
Quando un atomo di idrogeno è legato a un elemento altamente elettronegativo come l’ossigeno, si crea un legame polare in cui l’idrogeno assume una parziale carica positiva (δ+) e l’elemento più elettronegativo una parziale carica negativa (δ-). Quando molecole polari si avvicinano, l’idrogeno viene attratto dall’elemento più elettronegativo dell’altra molecola, creando così un legame a ponte di idrogeno.
Influenza sulla temperatura di ebollizione
La formazione del legame a idrogeno è evidenziata dalle temperature di ebollizione del fluoruro di idrogeno, dell’acqua e dell’ammoniaca. Questa forza intermolecolare attrattiva influisce direttamente sulla temperatura di ebollizione delle sostanze. Ad esempio, il fluoruro di idrogeno, nonostante abbia una massa molare minore rispetto ad altri composti con idrogeno, ha una temperatura di ebollizione più elevata, evidenziando l’importanza del legame a idrogeno.
Allo stesso modo, il legame a idrogeno si manifesta in composti organici come gli alcoli e le ammine primarie e secondarie, influenzando le loro temperature di ebollizione. Gli alcoli, caratterizzati da gruppi -OH che favoriscono la formazione di legami a idrogeno, hanno temperature di ebollizione superiori rispetto agli eteri, che non presentano questo tipo di legame.
Effetti su composti organici complessi e molecole biologiche
Nei composti organici complessi e nelle molecole biologiche, come le proteine e il DNA, il legame a idrogeno svolge un ruolo fondamentale. Ad esempio, è responsabile delle interazioni che determinano la struttura secondaria delle proteine, come l’α elica e il β foglietto, oltre a stabilizzare la struttura a doppia elica del DNA.
In conclusione, il legame a idrogeno svolge un ruolo cruciale nella determinazione delle proprietà fisiche e chimiche di molte sostanze, influenzando significativamente la loro temperatura di ebollizione e contribuendo alla formazione di strutture complesse in composti organici e molecole biologiche.