Il legame ionico è un tipo di legame chimico che si forma tra cationi e anioni a causa dell’attrazione elettrostatica tra particelle cariche di segno opposto. Questo tipo di legame è caratterizzato da una elevata differenza di elettronegatività tra le specie coinvolte, che porta alla formazione di ioni positivi e negativi.
Un esempio di legame ionico si ha nel caso del litio e del fluoro. Il litio, con una bassa elettronegatività, perde un elettrone diventando Li⁺, mentre il fluoro, con alta elettronegatività, guadagna un elettrone diventando F⁻. Questi ioni si dispongono in un reticolo cristallino di tipo cubico a facce centrate, formando un legame ionico stabile.
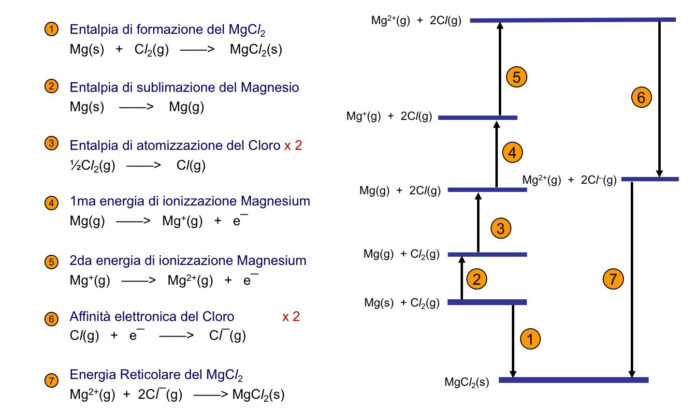
L’energia reticolare di un composto ionico, che misura la forza di questa attrazione, può essere calcolata usando l’equazione ΔH = C(Z⁺)(Z⁻)/R₀. Questa energia dipende dalle cariche degli ioni e dalla distanza interionica, e aumenta con l’aumentare delle cariche e diminuisce con l’aumentare delle dimensioni degli ioni.
I solidi ionici sono caratterizzati da durezza, fragilità, solubilità in acqua e elevate temperature di fusione. Inoltre, le soluzioni di composti ionici conducono elettricità. Per misurare l’energia reticolare di un cristallo ionico, si può utilizzare il ciclo di Born-Haber.
Per ulteriori approfondimenti sul legame ionico e sull’energia reticolare dei composti ionici, puoi consultare i seguenti link:
– Informazioni sui cationi: [cationi](https://chimica.today/chimica-generale/cationi)
– Informazioni sugli anioni: [anioni](https://chimica.today/chimica-generale/anioni)
– Elettronegatività: [elettronegatività](https://chimica.today/chimica-generale/elettronegativita)
– Litio: [litio](https://chimica.today/chimica-generale/litio)
– Fluoro: [fluoro](https://chimica.today/chimica-generale/fluoro)
– Reticolo cristallino: [reticolo cristallino](https://chimica.today/chimica-generale/reticolo-cristallino)
– Reticolo cubico a facce centrate: [cubico a facce centrate](https://chimica.today/chimica-generale/reticolo-cubico-a-facce-centrate)
– Ciclo di Born-Haber: [ciclo di Born-Haber](https://chimica.today/chimica-fisica/il-ciclo-di-born-haber)
– Solidi ionici: [solidi ionici](https://chimica.today/chimica-generale/solidi-ionici)