Orbitali ibridi: Legami doppi e tripli nelle molecole
I legami doppi e tripli incidono sul grado di insaturazione di una molecola. Per esempio, una molecola con un solo doppio legame ha un grado di insaturazione, mentre una con un triplo legame ha due gradi di insaturazione.
La rappresentazione di molte molecole attraverso la struttura di Lewis, che segue la regola dell’ottetto, diventa impossibile se si considerano solo legami semplici. In questo contesto, la regola dell’ottetto non viene rispettata se ogni coppia di atomi legati condivide solo due elettroni.
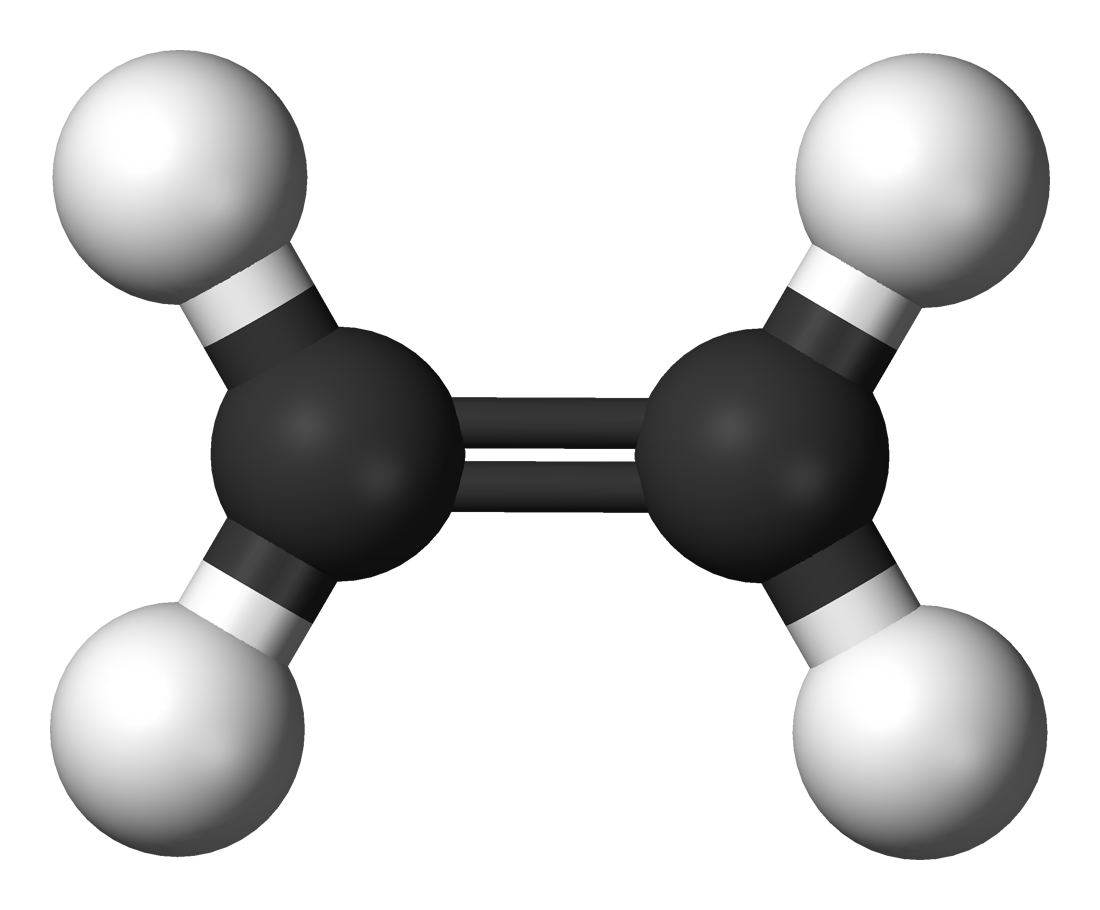
Ad esempio, consideriamo la molecola di etene C2H4. Ogni atomo di carbonio ha quattro elettroni di legame, e ogni atomo di idrogeno ha un solo elettrone di legame; quindi, vi sono (2 ∙ 4) + (4 ∙ 1) = 12 elettroni di legame.
La rappresentazione della molecola di etene, rispettando la regola dell’ottetto e considerando che tra gli atomi siano presenti solo legami semplici, è una figura da scartare in quanto contiene 14 elettroni.
La struttura corretta che rispetta sia la regola dell’ottetto che il numero di elettroni di legame è quella in cui è presente un doppio legame carbonio-carbonio.
Inoltre, il legame triplo presente nell’etino può essere spiegato in termini di orbitali ibridi. Nel caso dell’etino, ciascun atomo di carbonio ha due orbitali ibridi sp che sono disposti linearmente secondo un angolo di 180°. Gli orbitali p si trovano perpendicolari all’asse y e all’asse z. Dalla sovrapposizione di due orbitali ibridi si forma un legame di tipo σ, mentre dalla sovrapposizione dei due orbitali p y e dei due orbitali p z si formano due legami di tipo π.
Secondo la teoria del legame di valenza, i legami multipli si formano dalla sovrapposizione di più di un orbitale atomico. Il secondo e l’eventuale terzo legame si formano dalla sovrapposizione di orbitali non ibridati tramite la formazione di un legame π.
L’entalpia di legame mostra che il triplo legame è più forte rispetto al doppio legame e infine al legame singolo, mentre la lunghezza di legame diminuisce all’aumentare dei legami: ad esempio, la lunghezza di un legame C-C è di 154 pm, quella di un legame C=C è di 134 pm, mentre quella di un legame C≡C è di 120 pm.
I doppi legami sono presenti in diversi composti, come l’O2, il gruppo carbonilico, imminico e negli azocomposti. Allo stesso modo, il triplo legame è presente in molte molecole semplici come il N2 e il CO, così come nei cianuri e negli isocianuri.