Ibridazione degli Orbitali Atomici nello Studio delle Molecole e dei Legami: sp3, sp2, sp, sp3d, s2p3d
L’ibridazione degli orbitali atomici è un processo matematico attraverso il quale si combinano due o più orbitali atomici allo scopo di ottenere nuovi orbitali, anch’essi atomici. Tale concetto è fondamentale per comprendere la formazione dei legami σ e π e la geometria molecolare.
Nel caso delle molecole costituite da un numero di atomi maggiore, si rende necessario un diverso modello per descrivere la formazione dei legami, poiché la sovrapposizione degli orbitali s e p non sarebbe sufficiente a spiegare la geometria delle molecole più complesse.
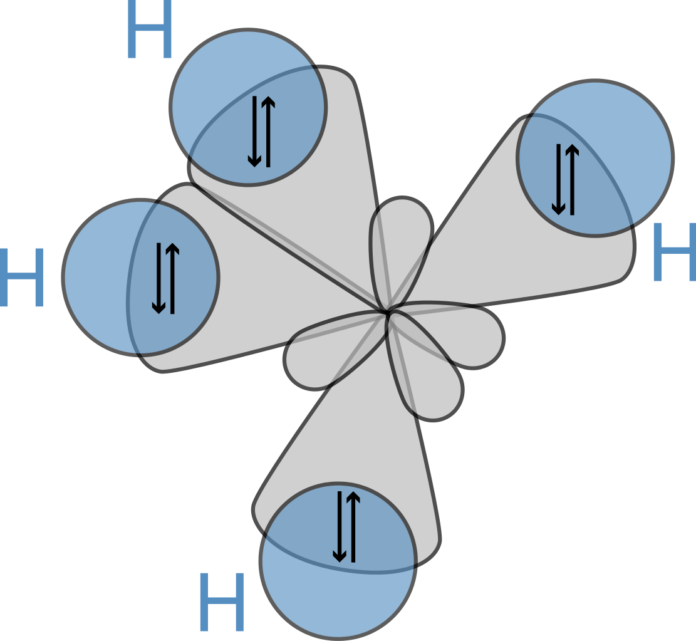
Un esempio è dato dal metano, il quale presenta una geometria tetraedrica con legami C-H equivalenti. Questa molecola ha portato all’introduzione del concetto di orbitali ibridi, definiti come un insieme di orbitali equivalenti con proprietà uguali e formati dalla combinazione di due o più orbitali aventi diversa energia.
Ibridazione sp3
Nell’ibridazione sp3, un elettrone dell’orbitale s e tre elettroni dell’orbitale p si combinano per formare quattro orbitali ibridi sp3, che si dispongono ai vertici di un tetraedro equilatero. Molecole come il metano (CH4), l’ammoniaca (NH3) e l’acqua (H2O) presentano questo tipo di ibridazione e la geometria tetraedrica corrispondente.
Ibridazione sp2
Nel caso dell’ibridazione sp2, tre elettroni sono in orbitale ibrido sp2 e un elettrone si trova in un orbitale p. Molecole come la formaldeide (HCHO), l’etene e il benzene mostrano questa ibridazione, con una struttura trigonale planare e angoli di 120° fra gli orbitali ibridi sp2.
Ibridazione sp
L’ibridazione sp, evidente ad esempio nel biossido di carbonio (O=C=O), vede due elettroni del carbonio formare due orbitali ibridi sp che si dispongono linearmente con angoli di 180°, mentre rimangono due elettroni negli orbitali p responsabili dei legami π.
Ibridazione sp3d
Con l’ibridazione sp3d, cinque orbitali ibridi si dispongono dando una geometria bipiramidale trigonale. L’esempio del fosforo evidenzia questa situazione, dove cinque elettroni spaiati danno luogo a questo tipo di ibridazione.
Ibridazione s2p3d
In presenza dell’ibridazione s2p3d, l’elemento deve appartenere almeno al terzo periodo e presentare sei elettroni di valenza. Un esempio è dato dai composti dello zolfo, come l’esafluoruro di zolfo (SF6), in cui gli elettroni presenti negli orbitali ibridi s2p3d formano sei legami covalenti con struttura ottaedrica.
Con queste varie forme di ibridazione, è possibile comprendere la vasta gamma di strutture molecolari che si possono formare e come gli orbitali atomici si combinino per dar luogo a legami e geometrie specifiche.