Orbitali molecolari: Legame chimico e antilegame
Il processo matematico chiamato sovrapposizione lineare degli orbitali atomici (LCAO) conduce alla formazione degli orbitali molecolari quando gli orbitali atomici si sovrappongono a un nuovo livello.
Un legame chimico avviene quando la forza di attrazione tra un elettrone e due nuclei supera la repulsione elettrostatica tra i nuclei. Si richiede che l’elettrone si trovi in una regione di spazio chiamata regione di legame.
Per visualizzare un orbitale molecolare, vengono considerati due atomi isolati con i rispettivi orbitali atomici, avvicinandoli fino a raggiungere una distanza internucleare corrispondente alla formazione di un orbitale molecolare.
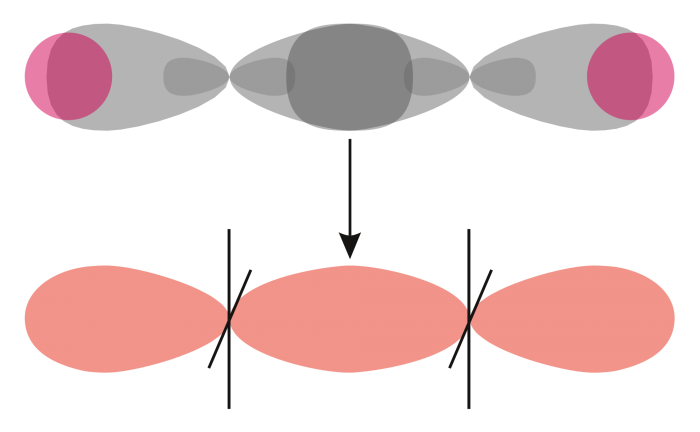
Ad esempio, nell’ione H2+, composto da due nuclei di idrogeno, gli orbitali atomici 1s si fondono gradualmente in un orbitale molecolare avente la maggiore densità di carica tra i due nuclei.
L’orbitale risultante è un orbitale di legame detto legame σ. Al contrario, un orbitale di antilegame σ* si oppone al legame a causa della sovrapposizione fuori fase delle funzioni d’onda degli orbitali atomici.
Nel caso di un orbitale di antilegame, le regioni con maggiore probabilità di trovare l’elettrone non si uniscono, generando una regione di spazio equidistante dai due nuclei, in cui la probabilità di trovare l’elettrone è zero, noto come piano nodale.
Gli elettroni presenti in un orbitale di antilegame non contribuiscono alla formazione del legame, ma si oppongono ad esso.
L’energia degli orbitali molecolari può essere correlata agli orbitali atomici da cui derivano attraverso i diagrammi M.O.
Nel caso dell’ione H2+, l’orbitale di legame viene riempito da un singolo elettrone, riducendo l’energia potenziale di una mole di coppie di nuclei di idrogeno. Nonostante la stabilità dall’energia potenziale, questa specie è particolarmente reattiva.
Nel caso della molecola H2, i due elettroni si posizionano nell’orbitale di legame, generando un ordine di legame pari a 1, corrispondente a un legame semplice.
Tuttavia, la molecola di He2, contenente quattro elettroni, non si forma in quanto l’ordine di legame risulta essere zero.
Estendendo il modello a atomi con elettroni nell’orbitale 2s, per la molecola Li2 si ottiene un ordine di legame pari a 1.
Analogamente, per la molecola eteronucleare LiH, viene formato un orbitale molecolare σ, mentre l’orbitale di antilegame σ* rimane vuoto, generando un ordine di legame pari a 1.
In conclusione, gli orbitali molecolari, sia di legame che di antilegame, giocano un ruolo fondamentale nella formazione e nella stabilità delle molecole.La teoria degli orbitali molecolari può essere applicata anche agli atomi che possiedono elettroni negli orbitali p. Gli orbitali di tipo p, come px, py e pz, hanno una forma lobata e sono perpendicolari tra loro, a differenza degli orbitali di forma sferica. Quando un atomo con elettroni negli orbitali p si lega ad un altro atomo, si formano due orbitali: uno di legame σ e uno di antilegame σ*.
L’orbitale molecolare di legame presenta una elevata densità di carica elettrica nella regione tra i due nuclei, causando una diminuzione dell’energia potenziale. Dall’altro lato, nell’orbitale di antilegame, la densità di carica elettrica è lontana dalla regione internucleare, con una superficie a metà tra i due nuclei dove la probabilità di trovare l’elettrone è pari a zero.
La combinazione degli orbitali py e pz porta alla formazione degli orbitali molecolari π, i quali sono formati dalla sovrapposizione laterale di due orbitali p. Il legame risultante π si estende al di sopra e al di sotto del piano in cui è situato il legame σ, che unisce i due nuclei, con una massima densità di carica elettrica sopra e sotto il piano dei due nuclei.
Per quanto riguarda la molecola di O2, ciascun atomo di ossigeno ha una configurazione elettronica 1s2, 2s2, 2p4, quindi presenta in totale 2 + 4 elettroni nel guscio esterno. Questi elettroni vanno posizionati a partire dall’orbitale σ.
In sintesi, la teoria degli orbitali molecolari offre una descrizione dettagliata della formazione e della natura dei legami all’interno delle molecole, permettendo di comprendere meglio il comportamento dei composti molecolari e di applicarli in diversi contesti chimici.