Il Folding delle Proteine: dalla Struttura Primaria alla Terziaria
Il processo di folding delle proteine è un fenomeno spontaneo causato da varie interazioni, quali interazioni idrofobiche, legami a idrogeno e forze di van der Waals. Le proteine sono polimeri costituiti da α-amminoacidi che, in condizioni normali di pH, temperatura e forza ionica, si dispongono in una geometria tridimensionale.
La Struttura Primaria
Ogni proteina è caratterizzata da una specifica sequenza di amminoacidi, che costituisce la sua struttura primaria. Le catene laterali dei venti amminoacidi che compongono le proteine presentano diversi gruppi funzionali come –OH, -SH, -COOH, -NH2, -CONH2.
La Struttura Secondaria
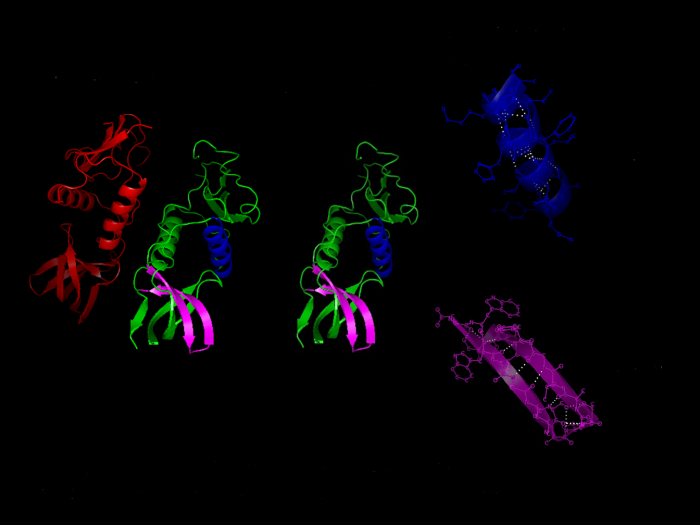
La struttura secondaria delle proteine è determinata da avvolgimenti a spirale o da disposizioni regolari di tratti più o meno lunghi della catena proteica. Questo livello di organizzazione è determinato dai legami a idrogeno tra gli amminoacidi della stessa catena o di catene diverse, e può manifestarsi attraverso strutture quali l’α-elica e il β-foglietto.
La Struttura Terziaria
Alcune proteine manifestano un ulteriore livello di organizzazione noto come struttura terziaria. Questo livello è determinato dal ripiegamento della catena proteica, compresi tratti che hanno già una loro struttura secondaria. Le interazioni intermolecolari svolgono un ruolo fondamentale nella struttura e nella stabilità della proteina. L’effetto idrofobico, ad esempio, è responsabile del folding delle proteine globulari.
Fattori Termodinamici
I fattori termodinamici che generano l’effetto idrofobico sono complessi e comprensione parziale. L’effetto idrofobico è il risultato della combinazione dell’effetto di idratazione (effetto entropico) e delle interazioni di van der Waals tra le molecole di soluto (effetto entalpico). Questo effetto contribuisce al collasso idrofobico, che è il ripiegamento delle proteine in cui le parti idrofobiche della catena polipeptidica si ripiegano verso l’interno della proteina, contribuendo alla stabilità termodinamica dello stato ripiegato.
Errori nel Folding e Malattie Associate
Alterazioni nel processo di folding proteico possono portare a malattie degenerative, come la fibrosi cistica e l’encefalopatia spongiforme degli ovini. Queste malattie sono causate da mutazioni che modificano il processo di folding proteico, portando a cambiamenti nella struttura delle proteine anziché dalla presenza di agenti patogeni come virus o batteri.
In conclusione, il folding delle proteine è un processo fondamentale che può determinare la funzione e la salute di un organismo. La comprensione di questo processo ha un impatto significativo sulla ricerca clinica e sulla comprensione delle malattie associate ai disordini nel folding proteico.