Il legame covalente polare e la sua determinazione
Il legame covalente è il processo mediante il quale gli atomi condividono gli elettroni tra loro. Tuttavia, quando gli atomi coinvolti hanno diversa elettronegatività, il legame viene definito “covalente polare”.
L’elettronegatività di un atomo rappresenta la sua capacità di attrarre gli elettroni di legame. Questo valore viene misurato attraverso la scala di Pauling e risulta fondamentale per comprendere la formazione di legami covalenti polari. Ad esempio, elementi come il fluoro (F) con elettronegatività pari a 4.0 e l’ossigeno (O) con 3.5, presentano una maggiore capacità di attrarre gli elettroni rispetto ad elementi come il bromo (Br) con elettronegatività pari a 2.8 e l’iodio (I) con 2.5.
Queste differenze causano una distribuzione asimmetrica di carica lungo il legame, dando luogo al legame covalente polare.
La polarità di un legame covalente polare può essere determinata considerando la differenza di elettronegatività tra gli atomi coinvolti. Se tale differenza è compresa tra 0.5 e 1.7, il legame è considerato polare.
Normalmente, gli atomi con maggiore elettronegatività presentano una carica parziale negativa, mentre quelli con minore elettronegatività manifestano una carica parziale positiva, creando un momento di dipolo elettrico lungo il legame.
Questa proprietà ha importanti implicazioni sulle caratteristiche fisiche e chimiche delle sostanze. Le molecole con legami covalenti polari tendono a presentare punti di fusione ed ebollizione più elevati rispetto a quelle con legami covalenti non polari.
In conclusione, la determinazione del legame covalente polare si basa sulla differenza di elettronegatività tra gli atomi coinvolti, creando una distribuzione asimmetrica di carica lungo il legame. Questa polarità influenza significativamente le proprietà delle sostanze.
Polarità del legame covalente nelle molecole: polarità e impatto sulle proprietà chimiche
La polarità del legame covalente nelle molecole bi o poliatomiche è influenzata dalla differenza di elettronegatività tra gli atomi coinvolti, determinando una distribuzione asimmetrica della carica elettrica legata agli elettroni di legame. Questa può essere forte o debole.
Ad esempio, il legame covalente tra l’idrogeno e il fluoro nell’acido fluoridrico (HF) è fortemente polarizzato, con una maggiore densità di carica vicino al fluoro, il quale possiede una maggiore elettronegatività rispetto all’idrogeno. Allo stesso modo, anche il legame covalente dell’acido cloridrico (HCl) è polarizzato, sebbene in misura minore rispetto a quello dell’acido fluoridrico.
La polarità dei legami covalenti può avere importanti implicazioni sulle proprietà chimiche delle molecole. Ad esempio, le molecole polari possono interagire con altre molecole polari attraverso interazioni di tipo dipolo-dipolo o formazione di legami idrogeno, influenzando quindi le loro proprietà fisiche e chimiche come il punto di ebollizione o la solubilità.
La polarità di un legame covalente, tuttavia, non può essere determinata unicamente dalla differenza di elettronegatività tra gli atomi coinvolti. Altri fattori, come la geometria molecolare o la presenza di specifici gruppi funzionali, possono influenzare la polarità complessiva della molecola.
In conclusione, la polarità dei legami covalenti può influenzare notevolmente le proprietà chimiche delle molecole. Comprendere e valutare la polarità dei legami è essenziale per comprenderne il comportamento chimico.
Covalente Polare e Apolare: Significato e Implicazioni
Spesso si discute della polarità dei legami tra atomi, ma cosa significa esattamente che un legame covalente sia polare o apolare?
In generale, un legame covalente si forma quando due atomi condividono uno o più elettroni. Tuttavia, quando gli atomi coinvolti hanno diversa elettronegatività, si forma un legame covalente polarizzato o eteropolare. Al contrario, se gli atomi hanno elettronegatività simili, si forma un legame covalente non polarizzato o omopolare, caratterizzato da una condivisione equa degli elettroni.
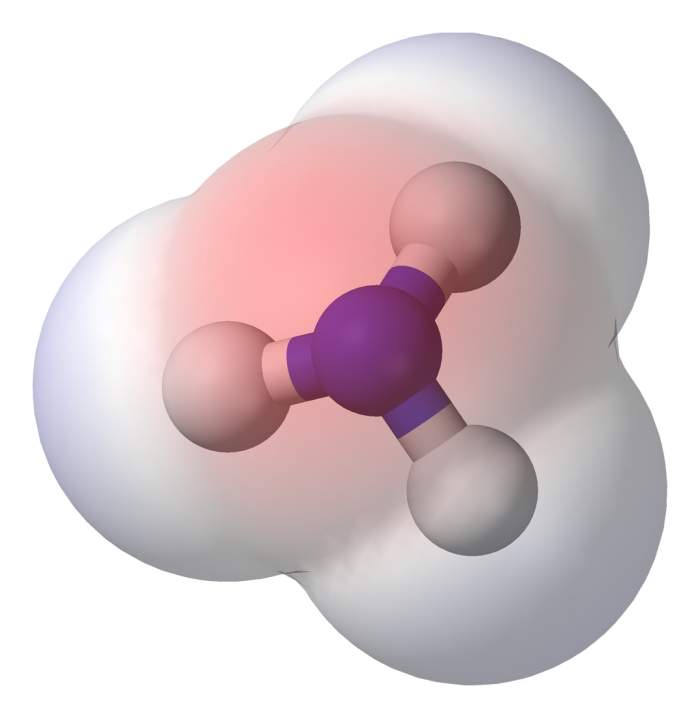
Ad esempio, prendiamo in considerazione la molecola dell’ammoniaca (NH3). In questa molecola, l’azoto e gli atomi di idrogeno formano legami covalenti polarizzati a causa della maggiore elettronegatività dell’azoto rispetto all’idrogeno, generando una distribuzione asimmetrica di carica e, di conseguenza, un momento dipolare nella molecola.
D’altra parte, ci sono molecole come il metano (CH4) e il CO2 che, nonostante abbiano legami covalenti polarizzati, non possiedono un momento dipolare a causa della loro geometria molecolare che annulla la risultante dei momenti dipolari.
In conclusione, la polarità di un legame covalente dipende dall’elettronegatività degli atomi coinvolti e dalla loro geometria molecolare. Mentre i legami polarizzati creano molecole con momenti dipolari, ci sono casi in cui non vi è un accumulo di cariche nella molecola nonostante i legami polarizzati.