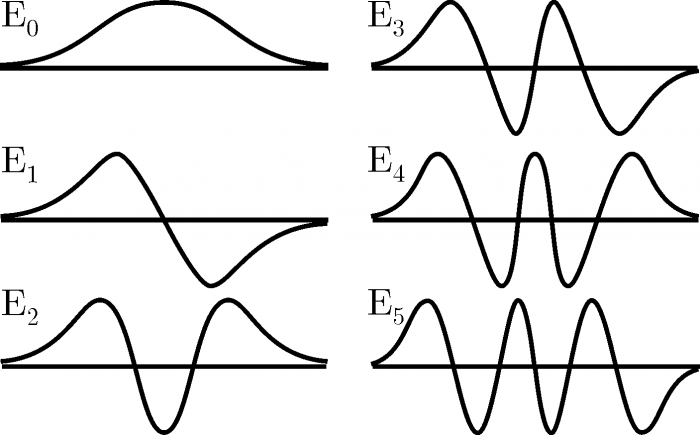
La quantizzazione dell’energia secondo l’equazione di Schrödinger
Il concetto della quantizzazione dell’energia a livello atomico è fondamentale per comprendere il comportamento delle particelle subatomiche. Secondo questo principio, le particelle non possono assumere o trasferire energia in modo continuo, ma solo in quantità discrete chiamate quanti. Questo implica che l’energia può essere ceduta o acquisita solo in piccoli pacchetti discreti.
Le particelle di dimensioni atomiche, come gli elettroni, mostrano proprietà sia corpuscolari che ondulatorie. L’equazione di Schrödinger, sviluppata sulla base di tali premesse, descrive il comportamento ondulatorio delle particelle. Collega l’energia totale ε di una particella di massa m, sottoposta all’azione di un certo potenziale U, all’ampiezza dell’onda ψ associata alla particella stessa.
La soluzione di questa equazione fornisce una relazione tra la funzione d’onda ψ e l’energia ε della particella, confermando che l’energia può assumere solo valori discreti, cioè è quantizzata. Inoltre, la funzione d’onda al quadrato, ψ2, rappresenta la probabilità di trovare la particella in una determinata area dello spazio.
Le distribuzioni energetiche sono un aspetto fondamentale nella comprensione del comportamento dei sistemi fisici, come nel caso dei sistemi gassosi. La legge di Boltzmann è utilizzata per calcolare la distribuzione più probabile delle particelle su diversi livelli energetici in un sistema. Secondo questa legge, il numero di particelle su un dato livello energetico diminuisce esponenzialmente all’aumentare dell’energia e aumenta con l’incremento della temperatura assoluta.
Il calcolo della distribuzione più probabile delle energie per un gran numero di particelle è una questione cruciale nella fisica statistica. La legge di Boltzmann può essere espressa come:
[N_i = costante times e^{(-varepsilon_i / kT)}]
dove Ni rappresenta il numero di particelle sul livello i-esimo con energia εi, k è la costante di Boltzmann e T è la temperatura assoluta.
In conclusione, sia l’equazione di Schrödinger che la legge di Boltzmann sono fondamentali per comprendere la fisica quantistica e le proprietà delle particelle di dimensioni atomiche. La loro comprensione è cruciale per analizzare il comportamento delle particelle e le loro distribuzioni energetiche in diversi sistemi fisici.