Il salicilato di sodio è utilizzato per i suoi effetti antinfiammatori, antipiretici e analgesici e anche per il suo effetto inibitorio sull’aggregazione piastrinica. È la base coniugata dell’acido 2-idrossibenzoico noto come acido salicilico il cui nome deriva dal latino salix, ovvero dalla pianta del salice dalla quale fu inizialmente identificato e derivato.
Il salicilato di sodio agisce anche come farmaco antinfiammatorio non steroideo (FANS). Si ritiene che le azioni farmacologiche del salicilato di sodio siano dovute all’inibizione delle cicloossigenasi, del trombossano A2 derivato dalle piastrine e del NF-κB.
Quest’ultimo è un complesso proteico funzionante come fattore di trascrizione che si trova all’interno delle cellule che, e se viene attivato da stimoli infiammatori come virus, batteri e stress ossidativo induce la produzione da parte delle cellule di molecole che alimentano il processo infiammatorio.
Proprietà del salicilato di sodio
Una soluzione di salicilato di sodio è alcalina. L’acido salicilico, infatti, ha una costante di dissociazione acida Ka di 10-3 pertanto, la costante relativa all’equilibrio di idrolisi del salicilato
C7H5O3– + H2O C7H6O3 + OH–
vale: Kb = Kw/Ka = 10-14/10-3 = 10-11
In una soluzione 0.1 M di salicilato di sodio si ha quindi che [OH–] = 10-6 ovvero pOH = 6 e pH = 8
Il salicilato di sodio è un solido bianco inodore, sensibile alla luce la cui solubilità in acqua aumenta sensibilmente all’aumentare della temperatura. È una molecola polare ed è solubile in etanolo, glicerolo, diossano e scarsamente solubile in etere etilico e non è bioaccumulabile.
Sintesi
Il salicilato di sodio in origine è stato sintetizzato con una corrente di riciclo di metilsalicilato con un eccesso di idrossido di sodio.

Un’altra via sintetica prevede la reazione ad elevate temperature e pressione di fenossido di sodio con biossido di carbonio. Recenti ricerche hanno portato alla sintesi del salicilato di sodio in condizioni più blande e con un’alta resa e concomitante riduzione dei sottoprodotti indesiderati.

Il processo prevede la reazione del fenossido di sodio con anidride carbonica in un unico passaggio diretto ad una temperatura superiore a circa 165°C per produrre direttamente salicilato di sodio che può, a sua volta essere convertito in acido salicilico.
Può essere ottenuto dalla reazione tra acido salicilico e carbonato di sodio da cui si ottiene anche acqua e biossido di carbonio.
Reazioni
Il salicilato di sodio, in presenza di idrossido di sodio e di ossido di calcio, dà luogo a una reazione di decarbossilazione con formazione di fenolo e carbonato di sodio.
Dalla reazione con l’acido cloridrico si ottiene l’acido salicilico e cloruro di sodio. Questa reazione può essere utilizzata per la determinazione quantitativa del salicilato tramite una titolazione acido-base utilizzando, quale indicatore, la fenolftaleina.
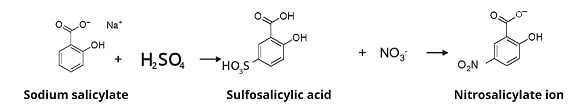
Dalla reazione tra salicilato di sodio e acido solforico si ottengono sali gialli dell’acido nitrosalicilico. Questa reazione viene utilizzata per la determinazione spettrofotometrica dei nitrati che, se presenti nell’ acqua potabile rappresentano un potenziale rischio per la salute soprattutto dei neonati.
Nei neonati, il nitrato viene ridotto in nitrito, che si combina con l’emoglobina nel sangue per formare metaemoglobina e porta ad una patologia nota come malattia del bambino blu.
Attività farmacologica
Le caratteristiche del salicilato di sodio sono simili a quelle dell’aspirina con la differenza che esso, rispetto all’aspirina, ovvero all’acido acetilsalicilico non è acetilato. L’acido salicilico è stato identificato negli estratti di corteccia di salice come composto antinfiammatorio ma, a causa del suo sapore amaro, sono stati sintetizzati e testati i derivati chimici dell’acido salicilico. Tra essi l’acido acetilsalicilico noto come aspirina ha eliminato il sapore amaro ma ha mantenuto l’azione antinfiammatoria.
Le differenze tra salicilato di sodio e aspirina stanno nel tempo di emivita che è molto maggiore e inoltre l’aspirina acetila la cicloossigenasi bloccandola irreversibilmente. Inoltre salicilato di sodio è considerato meno efficace nel ridurre il dolore rispetto all’aspirina ma viene usato da alcuni pazienti ipersensibili all’aspirina.

