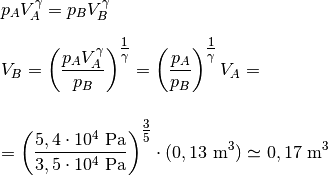Equazione di Poisson e trasformazione adiabatica: meccanismi e relazioni termodinamiche
La trasformazione adiabatica è un processo termodinamico in cui non avviene scambio di calore o materia tra un sistema e l’ambiente circostante. A differenza della trasformazione isotermica, in una trasformazione adiabatica l’energia viene trasferita all’ambiente sotto forma di lavoro, caratterizzandosi per il fatto che dQ = 0.
Applicando il primo principio della termodinamica a questo tipo di processo, emerge l’equazione dU = – dL, con dU che rappresenta la variazione dell’energia interna del sistema e dL il lavoro compiuto.
Si individuano due casi: quando dL è maggiore di zero, il sistema compie lavoro sull’ambiente, portando a una diminuzione dell’energia interna, mentre quando dL è minore di zero, si compie lavoro sul sistema, aumentando la sua energia interna.
Dunque, poiché dU = nCv dT = – dL, un lavoro compiuto dal sistema corrisponde a una diminuzione di temperatura, mentre un lavoro compiuto sul sistema conduce a un aumento di temperatura.
L’equazione per il lavoro adiabatico per un processo finito, L = – nCvΔT, offre informazioni significative sulle relazioni tra le variabili di stato (p, V, e T) in una trasformazione adiabatica. Integrando l’equazione dU = nCv dT = – dL, si ottiene una relazione fondamentale sull’andamento del processo, da cui deriva l’equazione di Poisson, espressa più in generale come TV^γ^-1 = costante, in cui γ rappresenta il rapporto tra i calori specifici a pressione costante e volume costante del gas.
Questa equazione presenta similitudini con la legge di Boyle per i gas ideali a temperatura costante (pV = costante).
Inoltre, l’equazione di Poisson è significativa nel contesto della termodinamica poiché fornisce informazioni cruciali sul comportamento dei gas in processi termodinici adiabatici.
L’analisi dell’equazione di Poisson e del lavoro adiabatico consente di comprendere i meccanismi e le relazioni termodinamiche che guidano i processi adiabatici, fornendo una migliore comprensione dei fenomeni termodinamici.
Infine, le informazioni sui calori specifici relativi ai diversi tipi di gas ideali forniscono ulteriori dettagli sul comportamento dei gas in relazione alle loro caratteristiche specifiche, contribuendo in modo significativo alla comprensione dei fenomeni termodinamici.