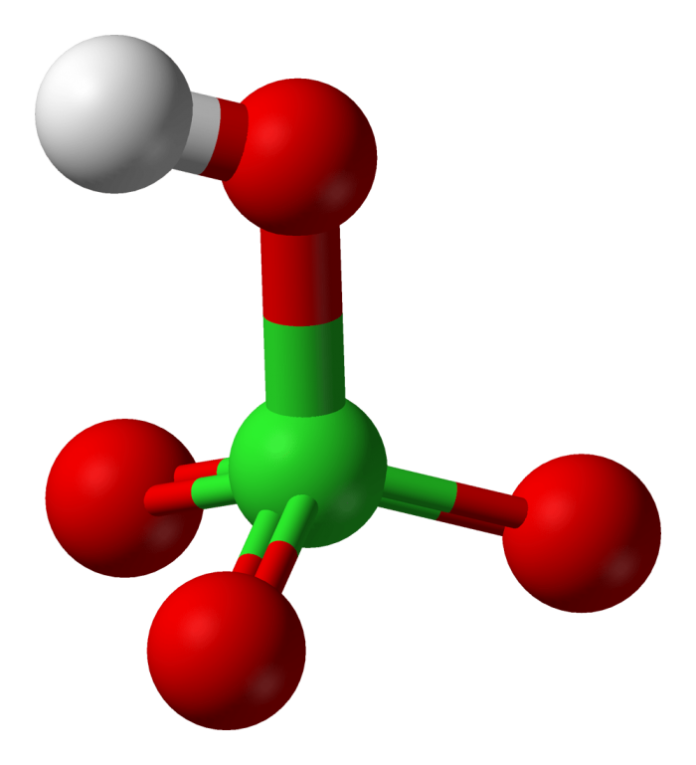
In chimica, gli acidi si distinguono in due ampie categorie: acidi ossidanti e non ossidanti. Tra i rappresentanti degli acidi ossidanti troviamo sostanze come l’acido nitrico, l’acido solforico e l’acido perclorico, con quest’ultimo che vede il cloro in uno stato di ossidazione di +7.
Classificazione e Esempi degli Acidi
Gli acidi sono suddivisi in due famiglie principali: gli acidi binari e gli acidi ternari. Gli acidi binari, anche noti come idracidi, includono HF (Acido Fluoridrico), HCl (Acido Cloridrico), HBr (Acido Bromidrico), HI (Acido Iodidrico), riconosciuti come acidi alogenidrici, oltre a H2S (Solfuro di Idrogeno), H2Se (Seleniuro di Idrogeno), H2Te (Tellururo di Idrogeno), HN3 (Acido Azoico), HAt (Acido Astatidrico) e HCN (Acido Cianidrico). Questi acidi binari sono composti unicamente da idrogeno e un non metallo.
D’altro canto, gli acidi ternari, detti ossiacidi, sono caratterizzati dalla presenza di tre elementi: idrogeno, un non metallo e ossigeno. Alcuni dei più noti sono HNO3 (Acido Nitrico), HNO2 (Acido Nitroso), H2SO4 (Acido Solforico) e H2SO3 (Acido Solforoso). Questi ultimi trovano impiego in diverse applicazioni industriali e di laboratorio.
Acidi Non Ossidanti: Ruolo e Comportamento Reducente
È importante rilevare che gli idracidi nei quali il non metallo esibisce un numero di ossidazione ridotto operano esclusivamente come agenti riducenti e, di conseguenza, non possiedono proprietà ossidanti. Questi acidi non possono ossidare i metalli nobili in soluzioni 1M, ma sono comunque capaci di reagire con i non metalli.
Invece, alcuni ossiacidi come l’acido solforico manifestano il loro potere ossidante soltanto in forma concentrata. In queste condizioni, lo zolfo passa da uno stato di ossidazione +6 a +4, sotto forma di SO2. A concentrazioni più basse, invece, l’agente ossidante primario è lo ione H+.
Acidi Ossidanti: Capacità Ossidante In Chimica
Alcuni acidi ternari, nel caso in cui il non metallo presenti uno stato di ossidazione particolarmente elevato, possono agire da potenti ossidanti. Per esempio, l’HNO3 con azoto a +5, H2SO4 con zolfo a +6 e HClO4 con cloro a +7 sono tutti acidi che mostrano il massimo stato di ossidazione per il rispettivo non metallo, attribuendo loro un pronunciato carattere ossidante.
Esempio di Reazione: Il Rame e l’Acido Nitrico
Un esempio chiaro di reazione che coinvolge un acido ossidante è quello del rame con l’acido nitrico. Il rame, essendo un metallo con potenziale di riduzione negativo tanto per la trasformazione in Cu+ quanto in Cu2+, è passibile di essere ossidato dall’acido nitrico:
Cu → Cu+ + 1 e– E° = – 0.521 V
Desideri approfondire le tue conoscenze sulla chimica degli acidi ossidanti e non ossidanti? Visita siti specializzati come Chemistry World o accedi a risorse didattiche come Khan Academy per informazioni aggiuntive.
Reattività del Rame in Ambienti Acidi: L’Influenza del Potenziale Redox
Il rame, un elemento metallico con un’ampia gamma di applicazioni, mostra differenti comportamenti a seconda dell’ambiente chimico in cui si trova. La sua reattività è guidata da fattori di elettrochimica quali i potenziali di riduzione standard.
# Reazioni di Ossidazione del Rame in Presenza di Acicio Cloridrico
Il potenziale standard di riduzione per l’ione rameico (Cu^2+) è di -0.337 V, secondo l’equazione elettrochimica:
Cu^2+ + 2 e^– → Cu E° = -0.337 V
Tuttavia, in presenza di un acido non ossidante come l’acido cloridrico (HCl), il rame non subisce ossidazione poiché il potenziale di riduzione dell’idrogeno (H^+) è di 0 V, come espresso dalla semireazione:
2 H^+ + 2 e^- → H2
Di conseguenza, le reazioni globali proposte:
2 Cu + 2 H^+ → 2 Cu^+ + H2 E_tot = -0.521 V
Cu + 2 H^+ → Cu^2+ + H2 E_tot = -0.337 V
posseggono potenziali totali inferiori allo zero, indicando che non avvengono spontaneamente.
# Ossidazione del Rame con Acido Nitrico
D’altra parte, nella reazione del rame con acido nitrico (HNO3), osserviamo due possibili esiti in funzione della concentrazione dell’acido. Con HNO3 diluito, si verifica la formazione di nitrato di rame (II) e monossido di azoto (NO) come prodotti:
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
Usando invece una soluzione concentrata di HNO3, il rame si ossida producendo nitrato di rame (II) e biossido di azoto (NO2):
Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O
Per ulteriori dettagli, si possono esplorare le informazioni sul comportamento del [nitrato di rame](https://chimica.today/chimica-generale/nitrato/) e sul [biossido di azoto](https://chimica.today/chimica-generale/biossido-di-azoto/) cliccando sui link forniti.