Proprietà, stabilità e elettroforesi dei colloidi liofili
I sistemi colloidali comprendono due fasi: una dispersa e una disperdente, classificati come colloidi liofobi (idrofobi se la fase disperdente è l’acqua) e colloidi liofili (idrofili se la fase disperdente è l’acqua). I colloidi liofili si ottengono trattando il materiale con il liquido disperdente, grazie alla sua affinità per il mezzo disperdente.
Includono gelatina, proteine come l’insulina, acidi nucleici, albumina, gomma e polistirene. I primi quattro formano colloidi liofili in acqua e sono chiamati colloidi idrofili, mentre la gomma e il polistirene formano colloidi liofili in solventi organici ed è per questo che sono indicati come colloidi lipofili.
Proprietà dei colloidi liofili
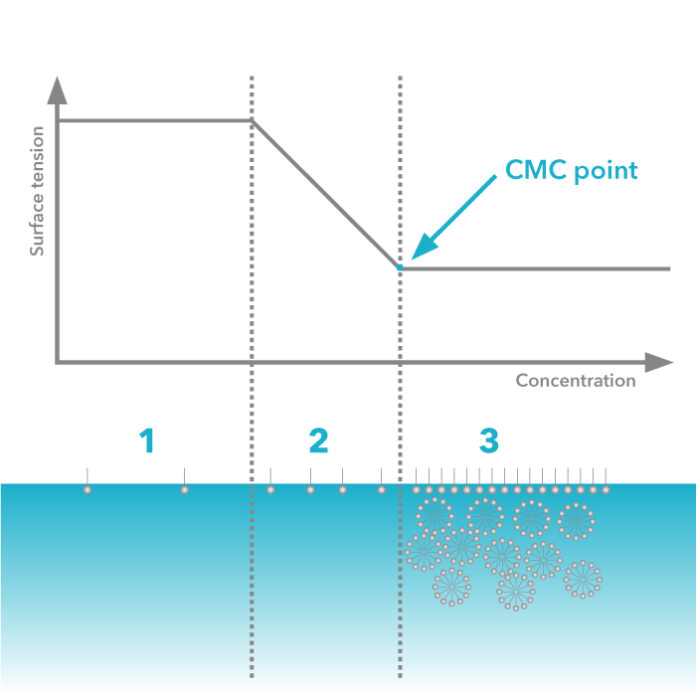
I colloidi liofili hanno elevata affinità per le molecole di solvente, formando soluzioni praticamente omogenee. Questi comprendono soluzioni colloidali di grosse molecole (macromolecole) e soluzioni colloidali di aggregati di molecole, chiamate micelle.
Nel caso di macromolecole si hanno soluzioni colloidali molecolari, mentre nel caso di aggregati di molecole o micelle si hanno soluzioni colloidali micellari o di colloidi di associazione. Una soluzione micellare è un sistema colloidale di associazione di macromolecole anfipatiche.
Stabilità
La stabilità delle soluzioni colloidali molecolari è principalmente dovuta alla carica elettrica delle macromolecole e alla solvatazione delle stesse. La solvatazione delle macromolecole è particolarmente importante in quanto agisce come un mantello protettivo, impedendo alle macromolecole di aggregarsi e separarsi dal mezzo disperdente.
L’aggiunta di elettroliti può influenzare la solvatazione delle macromolecole, portando alla flocculazione. La carica elettrica delle particelle colloidali è anche responsabile del fenomeno dell’elettroforesi, che trova applicazioni in campo biologico e nell’analisi clinica.
Elettroforesi
L’elettroforesi permette di stabilire il segno della carica elettrica delle particelle colloidali, dimostrando che le particelle di un dato colloide hanno tutte carica elettrica dello stesso segno. Trova applicazioni in campo biologico e nell’analisi clinica, permettendo di separare, identificare e dosare le proteine contenute in un liquido biologico come siero, plasma, estratti cellulari ecc.
Proteine
La carica elettrica dei colloidi molecolari può derivare dal carattere anfotero della sostanza dispersa, come nel caso delle proteine che possono assumere un comportamento acido o basico a seconda del pH del mezzo disperdente. Il punto isoelettrico della proteina è il valore di pH del mezzo disperdente al quale la proteina resta immobile a seguito di un campo elettrico applicato, ed è anche il punto in cui la soluzione colloidale di una proteina diventa poco stabile e tende a flocculare.