Il perossidisolfato o persolfato è un anione poliatomico derivante dall’acido perossidisolforico ed ha formula S2O82-.
Nella struttura è presente un legame perossidico a ponte tra i due atomi di zolfo che presentano quindi rispettivamente numero di ossidazione +6.
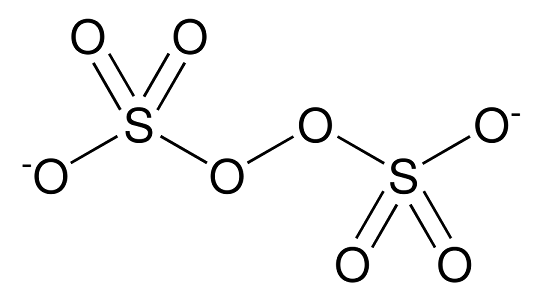 Proprietà
Proprietà
I suoi principali sali sono quelli di ammonio, sodio e potassio che si presentano come solidi cristallini di colore bianco.
È un energico ossidante e il potenziale relativo alla semireazione:
S2O82- + 2 e– → 2 SO42-
è pari a 2.0 V. Si noti che gli atomi di ossigeno del legame perossidico passano da numero di ossidazione -1 a -2.
Questo elevato potenziale di riduzione rende il persolfato un agente ideale nell’ossidazione chimica in situ e quindi usato per la bonifica del suolo e delle acque sotterranee. Oltre all’ossidazione diretta i persolfati possono formare radicali che, a causa della loro reattività, tendono rapidamente ad ossidare altri composti
Sintesi del perossidisolfato
I perossidisolfati sono ottenuti per via elettrolitica da idrogenosolfato:
2 HSO4– → S2O82-+ H2
Reagisce con i materiali combustibili e riducenti. Si decompone per riscaldamento. Questo produce fumi tossici e corrosivi inclusi gli ossidi di zolfo. Reagisce violentemente con i metalli in polvere e le basi forti.
Reazioni
Dà reazioni di decomposizione i cui prodotti variano al variare del pH.
In soluzioni alcaline, neutre o in presenza di acidi diluiti si decompone secondo la reazione:
2 S2O82- → 4 HSO4– + O2
H2S2O8 + H2O → H2SO5 + H2SO4
Dalla reazione di ottiene l’acido solforico e l’acido perossimonosolforico detto acido di Caro.
Reagisce con:
- metalli per dare i rispettivi solfati:
Cu + S2O82- → CuSO4 + SO42-
- acqua in ambiente acido per dare idrogenosolfato e perossido di idrogeno:
S2O82- + H2O → 2 HSO4– + H2O2
Usi
I persolfati sono componenti chiave in molti processi per la sintesi di polimeri in cui sono utilizzati quali iniziatori nella polimerizzazione del lattice e della gomma sintetica. Nell’industria elettronica sono usati nella produzione di circuiti stampati
Sono usati quali mordenti per nichel, titanio e leghe di zinco, per pulire e alluminio, ottone, rame e molte altre.
L’industria cosmetica ha sviluppato formulazioni che utilizzano persolfati per migliorare lo sbiancamento dei capelli.
Per le loro proprietà ossidanti sono usati nella preparazione di aldeidi, chetoni, acidi carbossilici e chinoni.

