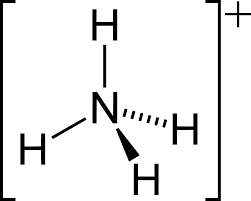
Lo ione ammonio è un catione poliatomico avente e formula NH4+ in cui l’atomo di azoto è ibridato sp3.
Geometria molecolare
L’azoto ha configurazione elettronica 1s2,2s2, 2p3 e presenta 3 elettroni spaiati e un doppietto elettronico solitario che si lega ad un atomo di idrogeno tramite legame dativo e pertanto assume una carica positiva.
Essendo presenti 4 coppie di legame la geometria molecolare dello ione ammonio è tetraedrica con un angolo di legame di 109.28°.
L’ ammonio si forma dall’equilibrio:
NH3 + H2O ⇌ NH4+ + OH–
in cui l’ammoniaca agisce da base secondo Brønsted-Lowry e lo ione ammonio è il suo acido coniugato.
Reagisce con le basi secondo Brønsted-Lowry per dare ammoniaca:
NH4+ + B– → NH3 + HB
Lo ione ammonio è comune anche nei composti organici in cui uno o più atomi di idrogeno sono sostituiti da altrettanti gruppi alchilici e possono essere ottenuti dalla reazione tra un’ammina e un acido. A seconda del numero di atomi di idrogeno sostituiti si hanno ioni ammonio primari, secondari, terziari o quaternari.
Composti contenenti ione ammonio
Tra i composti contenenti lo ione ammonio vi è il solfato di ammonio (NH4)2SO4 che viene usato come fertilizzante in terreni alcalini. Lo ione ammonio infatti in acqua idrolizza secondo l’equilibrio:
NH4+ + H2O ⇌ NH3 + H3O+
L’azione dello ione ammonio è quindi duplice in quanto fornisce azoto necessario alla crescita delle piante e abbassa il pH del terreno.
Funzione analoga al solfato di ammonio viene svolta dal cloruro di ammonio NH4Cl.
Tra i sali più noti contenenti lo questo ione vi è il carbonato di ammonio (NH4)2CO3 che veniva utilizzato come polvere polvere lievitante e il carbonato acido di ammonio NH4HCO3 largamente utilizzato sia come agente lievitante che come antiacido oltre che nei prodotti farmaceutici e come fertilizzante.
L’ammonio è una fonte di azoto che le piante acquatiche possono assorbire per ottenere amminoacidi o proteine pertanto alte concentrazioni ne favoriscono la crescita di alghe o piante acquatiche.
Inoltre i batteri possono convertire lo ione ammonio in nitrato nel processo di nitrificazione che riduce la quantità di ossigeno disciolto nell’acqua.

