Spettro atomico: la relazione con la Costante di Rydberg
Durante il passaggio della luce solare attraverso un prisma ottico, essa si scompone in varie radiazioni colorate. Questo spettro continuo mostra una serie di colori che vanno dal viola al rosso senza presentare zone d’ombra tra di loro.
Mentre le sostanze solide portate all’incandescenza emettono uno spettro continuo, le sostanze allo stato gassoso producono uno spettro discontinuo. Inoltre, le molecole emettono uno spettro discontinuo a bande, mentre gli atomi danno luogo a uno spettro discontinuo a righe.
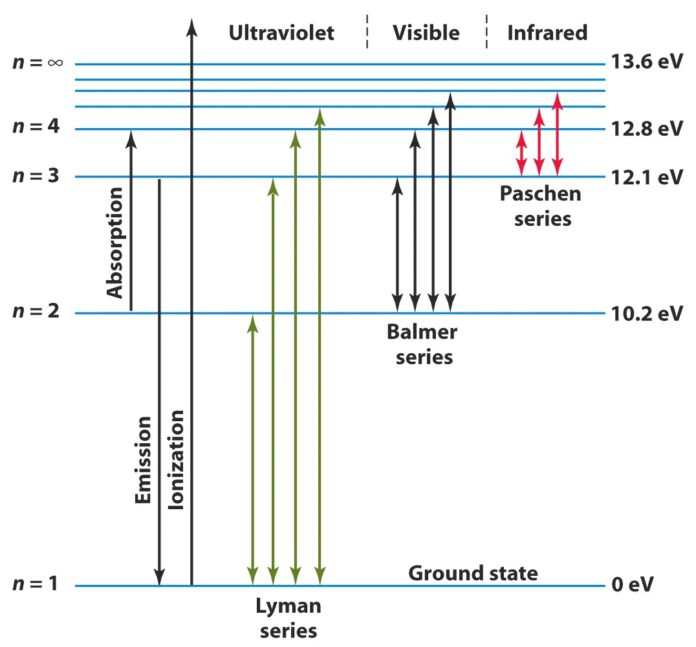
Uno degli esempi più semplici di spettro a righe è lo spettro atomico dell’idrogeno. Le righe Hα, Hβ, Hγ e altre sono chiaramente visibili nello spettro e hanno lunghezze d’onda misurate con precisione.
La costante di Rydberg, indicata con R_H, è 109677.76 cm^-1 e la frequenza delle righe degli spettri dell’idrogeno può essere rappresentata dall’equazione generale: ν = R_H (1/n_1^2 – 1/n_2^2).
Secondo la teoria di Bohr del 1913, l’elettrone si muove intorno al nucleo su orbite circolari con raggi definiti dalla quantizzazione della quantità di moto. L’energia totale dell’elettrone diventa E_n = -2π^2 m_r e^4/n^2 h^2, dove m_r è la massa ridotta.
Successivamente, la meccanica quantistica ha confermato le conclusioni di Bohr e ha proposto che l’emissione di energia è la conseguenza del passaggio da uno stato energetico stazionario a un altro con energia inferiore, calcolabile attraverso l’equazione ΔE = E_n2 – E_n1 = hν = hῡc.
Bohr ha ottenuto l’espressione della costante di Rydberg utilizzando le equazioni sopra menzionate: R_H = 2π^2 m_r e^4/ch^3.
Il minimo valore di energia per l’atomo di idrogeno è ricavato ponendo n=1 ed è indicato come E_1 = – R_H.
La teoria conferma che i valori più elevati di ΔE si registrano quando l’elettrone passa dalle orbite periferiche alla prima orbita stazionaria. Questi “salti” corrispondono alle energie delle righe dello spettro U.V. dette di Lyman.
In sintesi, la teoria di Bohr e la meccanica quantistica hanno confermato i risultati per lo spettro dell’idrogeno, dimostrando quanto sia crucial la costante di Rydberg nella comprensione dell’atomo di idrogeno.