La periodicità della tavola periodica moderna, che segue la suddivisione in periodi e gruppi proposta da Mendeleev, è stata individuata da Alexandre Beguyer de Chancourtois nel 1862, quando ha identificato una periodicità nelle proprietà fisiche degli elementi. Il primo a suddividere i 52 elementi conosciuti in 13 gruppi, basandosi sulle loro proprietà fisiche e chimiche, è stato William Odling. Recenti ricerche e studi hanno semplificato questa grande scoperta e hanno portato all’attuale tavola periodica.
Successivamente, nel 1863, John Newlands catalogò gli elementi in base al peso atomico, notando che le proprietà fisiche e chimiche si ripetevano ad intervalli di otto elementi, enunciando così la legge delle ottave. Questa legge contribuì significativamente alla comprensione della disposizione degli elementi.
Mendeleev, nel 1869, predisse l’esistenza di altri elementi, descrivendone le loro proprietà chimiche e fisiche. L’importanza della tavola periodica e delle previsioni di Mendeleev furono riconosciute pochi anni dopo, in seguito alla scoperta degli elementi scandio, gallio e germanio, che occupavano alcuni posti vuoti nella tavola e possedevano le proprietà fisiche previste secondo la loro posizione.
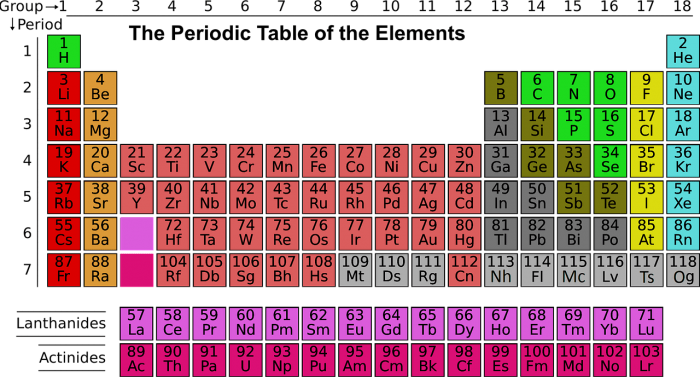
All’interno della tavola periodica, ci sono sette file orizzontali chiamate periodi e 18 colonne verticali chiamate gruppi. Inoltre, ci sono due file che separano i lantanidi e gli attinidi. La tavola periodica moderna costituisce un supporto indispensabile per ogni chimico, poiché ne conserva la suddivisione in periodi e gruppi.
Gli elementi del blocco s sono costituiti da quelli del 1° e del 2° gruppo e sono tutti metalli, ad eccezione dell’idrogeno. Gli elementi del primo gruppo, noti come metalli alcalini, sono litio, sodio, potassio, rubidio, cesio e francio. Hanno tutti numero di ossidazione +1 e sono caratterizzati da bassa energia di prima ionizzazione e bassa elettronegatività.
Gli elementi del secondo gruppo, detti metalli alcalino-terrosi, sono berillio, magnesio, calcio, stronzio, bario e radio, che è un elemento radioattivo. Hanno tutti numero di ossidazione +2 e presentano maggiore durezza, punto di fusione più alto e densità maggiore rispetto ai metalli alcalini. I sali di calcio, stronzio e bario danno colorazioni caratteristiche ai saggi alla fiamma.
Gli elementi del blocco p si trovano a destra della tavola periodica e sono separati dagli elementi del blocco s tramite il blocco dei metalli di transizione. Appartengono al blocco p gli elementi di sei gruppi, ognuno caratterizzato da specifiche proprietà. Ad esempio, gli elementi del Gruppo 13, come il boro, hanno configurazione elettronica s2, p1 e, ad eccezione del boro, sono tutti metalli.
I Gruppi 14 e 15, invece, includono elementi con configurazioni elettroniche diverse e possono presentare più numeri di ossidazione. Questa varietà di proprietà e comportamenti chimici è ciò che rende la tavola periodica così complessa e affascinante per i chimici.
In conclusione, la tavola periodica degli elementi e la sua struttura periodica rappresentano un campo di studio interessante e in continua evoluzione, offrendo un’importante base di conoscenza per comprendere il comportamento e le proprietà degli elementi chimici.
Elementi del Gruppo 15, 16, 17, 18 e del blocco d nella Tavola Periodica
I componenti del Gruppo 15 della Tavola Periodica, noti anche come Pnicogeni, presentano una configurazione elettronica s2, p3 e possono manifestare differenti numeri di ossidazione. Tale gruppo include l’Azoto e il Fosforo, classificati come non metalli, l’Arsenico e l’Antimonio, classificati come semimetalli, e il Bismuto, classificato come metallo.
Nel Gruppo 16, i componenti presentano una configurazione elettronica s2, p4 e possono manifestare vari numeri di ossidazione. Questo gruppo include il Zolfo, il Selenio, il Tellurio e il Polonio, che è radioattivo, e sono tutti classificati come non metalli.
I membri del Gruppo 17, noti come Alogenii, presentano una configurazione elettronica s2, p5 e possono manifestare differenti numeri di ossidazione, ad eccezione del Fluoro che ha costantemente un numero di ossidazione pari a -1. Questo gruppo include il Cloro, il Bromo, l’Iodio e l’Astato, noti per la loro reattività e elevata elettronegatività.
Il Gruppo 18 è composto dai Gas Nobili, che presentano una configurazione elettronica s2, p6, ad eccezione dell’Elio che ha una configurazione elettronica 1s2. Questi elementi sono poco reattivi e solo il Xeno e il Kripto formano composti di fluoruro. A parte il Radon, gli altri elementi del gruppo possono essere trovati in tracce nell’atmosfera.
Infine, il blocco d include gli elementi dal terzo al dodicesimo gruppo, in cui avviene il progressivo riempimento dell’orbitale d, passando da s2d1 a s2d10, con alcune eccezioni come nel caso del Cromo, che ha una configurazione s1d5, e dei membri del gruppo 11 (rame, argento, oro, e roentgenio), noti come metalli nobili, che hanno una configurazione s1d10.
L’informazione sulla Tavola Periodica è cruciale per comprendere le caratteristiche e il comportamento degli elementi chimici, oltre a essere fondamentale per lo sviluppo di studi e applicazioni nell’ambito della chimica.