Acido arsenico: struttura, sintesi, e usi
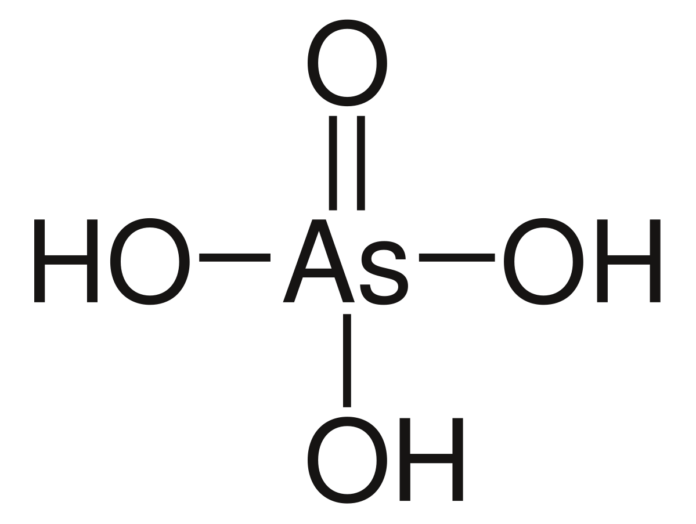
L’acido tetraossoarsenico (V), noto anche come acido arsenico, con formula H3AsO4, è un ossiacido analogo all’acido fosforico, in cui l’arsenico presenta un numero di ossidazione +5.
Struttura
L’arsenico è ibridato sp3 ed è legato a tre gruppi -OH e a un atomo di ossigeno tramite doppio legame, conferendo alla molecola una geometria molecolare tetraedrica con una distribuzione di carica asimmetrica. Questa struttura rende la molecola polare.
L’acido arsenico è un solido trasparente, igroscopico e in acqua dà luogo a tre equilibri di dissociazione che lo rendono un acido triprotico. Le costanti di dissociazione relative a questi equilibri sono rispettivamente Ka1 = 5.8 ∙ 10-3, Ka2 = 1.1 ∙ 10-7 , e Ka3 = 3.2 ∙ 10-12.
Nella nomenclatura tradizionale, è omesso il prefisso “orto-“, mentre per gli altri ossiacidi dell’arsenico è mantenuto il prefisso “meta-” per l’acido metaarsenico HAsO3 e il prefisso “piro-” per l’acido piroarsenico H4As2O7.
Sintesi
L’acido arsenico può essere ottenuto per ossidazione dell’ossido di arsenico (III) in presenza di acido nitrico secondo la reazione:
2 HNO3 + As2O3 + 2 H2O → 2 H3AsO4 + N2O3.
Può anche essere ottenuto a partire dall’arsenico in presenza di ozono:
2 As + 3 H2O + 5 O3 → 2 H3AsO4 + 5 O2.
Inoltre, la reazione tra acido arsenico e molibdato di ammonio in presenza di acido nitrico può essere utilizzata nell’analisi degli anioni per via umida degli arseniati.
Usi
L’acido arsenico, a causa della sua tossicità, è scarsamente utilizzato. Tuttavia, viene impiegato per l’ottenimento di arseniati e per la sintesi di alcuni coloranti e composti organici. È anche il precursore di alcuni pesticidi ed è utilizzato come agente di finitura nella lavorazione del vetro e come conservante del legno.