Anidride Acetica: Produzione, Utilizzi e Reazioni
L’anidride etanoica, conosciuta come anidride acetica, è un liquido incolore con un odore molto simile a quello dell’aceto, caratterizzato dalla sua densità simile a quella dell’acqua.
Essa costituisce la forma più semplice tra le anidridi ed è indicata con la formula (CH3CO)2O. L’odore tipico di aceto è dovuto alla reazione dell’anidride acetica con il vapore acqueo nell’aria, che porta alla formazione di acido acetico secondo la seguente reazione:
(CH3CO)2O + H2O → 2 CH3COOH.
Nonostante non formi legami a idrogeno, l’anidride acetica ha un punto di ebollizione di circa 140°C, a causa della sua elevata polarità molecolare e della presenza di forze di van der Waals e interazioni dipolo-dipolo.
La sua struttura molecolare è rappresentata nella figura qui sotto: [struttura anidride acetica](https://chimica.today/wp-content/uploads/2019/08/struttura-1.png)
Sintesi
L’anidride acetica si ottiene dalla reazione dell’etanoato di metile con monossido di carbonio:
CH3COOCH3 + CO → (CH3CO)2O.
Può inoltre essere prodotta tramite la reazione esotermica di un chetene con acido acetico:
H2C=C=O + CH3COOH → (CH3CO)2O.
Reazioni
L’anidride acetica reagisce con gli alcoli per formare un estere:
(CH3CO)2O + CH3CH2OH → CH3CO2CH2CH3 + CH3COOH.
In ambiente acido, reagisce con il fenolo per formare il fenilacetato e l’acido acetico, come mostrato nell’immagine qui sotto: [fenilacetato](https://chimica.today/wp-content/uploads/2019/08/fenilacetato.png)
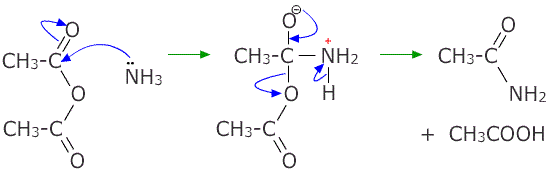
Inoltre, reagisce con l’ammoniaca e con le ammine primarie, secondarie e terziarie per formare gli ammidi, come illustrato nella seguente immagine: [preparazione di ammidi](https://chimica.today/wp-content/uploads/2019/08/preparazione-di-ammidi.gif)
Utilizzi
L’anidride acetica è impiegata nella produzione di acetato di cellulosa, nella lucidatura dei metalli, nella fabbricazione di fluidi frenanti, coloranti ed esplosivi. È anche utilizzata nella produzione di acido acetilsalicilico, noto come aspirina, a partire dall’acido salicilico.
Inoltre, l’anidride acetica è ampiamente impiegata nelle reazioni di acetilazione in cui è legata a una molecola formando un gruppo acetile. Come additivo alimentare, è utilizzata per addensare i cibi e come stabilizzatore ed emulsionante.