La reazione di evoluzione dell’ossigeno (OER) è una reazione che comporta la generazione di ossigeno molecolare attraverso reazioni chimiche come l’elettrolisi dell’acqua in ossigeno e idrogeno e l’evoluzione elettrocatalitica dell’ossigeno da ossidi e ossiacidi.
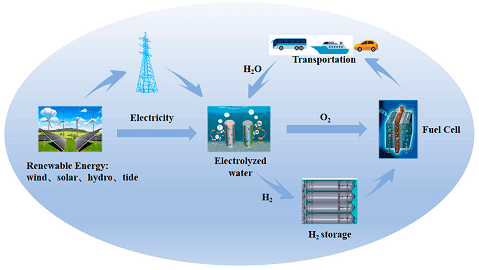
La conversione dell’energia in un vettore energetico chimico a zero emissioni come l’idrogeno è un’alternativa che, grazie all’elevata densità energetica dell’idrogeno, può essere utilizzata in modo versatile, come ad esempio il riscaldamento pulito o l’elettricità.
 energia pulita
energia pulita
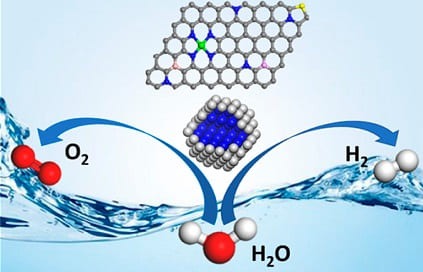
La reazione di evoluzione dell’ossigeno è il processo di generazione di ossigeno molecolare mediante una reazione chimica, solitamente dall’acqua. Per l’elettrolisi dell’acqua, la reazione complessiva può essere divisa in due semireazioni ovvero la reazione di evoluzione dell’idrogeno (HER) e reazione di evoluzione dell’ossigeno (OER).
Lo sviluppo di celle adatte alla scissione dell’acqua per la produzione di idrogeno da fonti rinnovabili e di celle a combustibile per un’efficace conversione dell’idrogeno in elettricità è diventato prioritario per un futuro sostenibile. La reazione di evoluzione dell’ossigeno elettrocatalitica è una reazione di grande interesse responsabile della conversione dell’elettricità rinnovabile in combustibili immagazzinabili.
La reazione di evoluzione dell’ossigeno avviene all’anodo e comporta un processo di trasferimento di quattro elettroni che richiede una sovratensione ovvero un sovrappiù di energia elettrica necessaria per vincere le resistenze della reazione notevolmente elevato rispetto a quella dell’HER.
Pertanto la reazione di evoluzione dell’ossigeno costituisce il principale ostacolo al miglioramento dell’efficienza complessiva della scissione elettrochimica dell’acqua che è considerata un metodo promettente per generare energia rinnovabile e sostenibile dall’idrogeno.
Reazioni
Il crescente consumo di combustibili fossili e la quantità limitata di risorse naturali hanno motivato la ricerca di energie rinnovabili e sostenibili. La scissione dell’acqua in H2 mediante elettrocatalisi è un modo promettente e rispettoso dell’ambiente per ottenere il combustibile idrogeno gassoso in modo green.
 Reazione
Reazione
Nella scissione dell’acqua all’anodo avviene la reazione di evoluzione dell’ossigeno e al catodo la reazione di evoluzione dell’idrogeno.
Le semireazioni di scissione dell’acqua in soluzioni acide sono:
HER: 2 H+(aq) + 2 e– → H2(g)
OER: 2 H2O(l) → O2(g) + 4 H+(aq) + 4 e–
Le semireazioni di scissione dell’acqua in soluzioni basiche sono:
HER: 2 H2O(l) + 2 e– → H2(g) + 2 OH–
OER: 4 OH–(aq) → O2(g) + 2 H2O(l) + 4 e–
In condizioni ideali, il potenziale necessario in condizioni standard è ΔE = 1.23 V. Tuttavia, a causa della cinetica di reazione lenta, soprattutto per la reazione di evoluzione dell’ossigeno, è necessaria un’elevata sovratensione. Pertanto, sono necessari catalizzatori efficienti per ridurre la sovratensione al fine di migliorare l’efficienza della scissione dell’acqua.
Reazione di evoluzione dell’ossigeno e catalizzatori
Gli elettrocatalizzatori a base di metalli di transizione, che offrono la possibilità di realizzare la reazione di evoluzione dell’ossigeno a basso costo, ad alta attività e stabili in soluzione alcalina, hanno pertanto attirato un notevole interesse di ricerca negli ultimi anni.
Poiché i metalli di transizione sono termodinamicamente instabili in mezzi acidi, i composti di metalli nobili vengono utilizzati come elettrocatalizzatori nella scissione dell’acqua. Singoli ossidi di metalli nobili, l’ossido di rutenio e l’ossido di iridio hanno applicazioni nell’elettrolisi dell’acqua.
 catalizzatori
catalizzatori
Per l’OER, sono stati sviluppati numerosi catalizzatori a base di ossido/idrossido di metalli di transizione per sostituire i catalizzatori più utilizzati a base di iridio e rutenio. Tuttavia essi hanno generalmente una bassa conduttività elettronica che limitando l’elettrocatalisi.
Gli elettrocatalizzatori a base di ossidi di metalli di transizione (TMO) come perovskite, spinelli, salgemma e rutilo hanno suscitato un grande interesse per catalizzare la reazione di evoluzione dell’ossigeno grazie al loro basso costo, alla superiore resistenza all’ossidazione nell’elettrolita alcalino e alla loro attività sebbene nessun TMO sia in grado di soddisfare pienamente i requisiti per l’utilizzo in campo industriale.
I ricercatori sono stati in grado di creare un catalizzatore composito di grafene–solfuro di cadmio supportato da polimeri. Il grafene, scoperto dai fisici fisici Andrej Gejm e Konstantin Novosëlov, è stato creato riducendo l’ossido di grafene , che è stato poi rivestito con solfuro di cadmio (CdS) utilizzando un metodo solvotermico.

