
La I.U.P.A.C. definisce l’energia di dissociazione di legame come l’entalpia (per mole) richiesta per rompere un dato legame di una specifica entità molecolare mediante omolisi. L’omolisi, o scissione omolitica, è la scissione di un legame in modo tale che ciascun frammento risultante conservi uno degli elettroni precedentemente legati.
L’energia di dissociazione è l’energia richiesta per rompere un legame e formare due frammenti atomici o molecolari. Pertanto, un legame molto stabile ha una grande energia di dissociazione che è sempre un valore positivo poiché la rottura dei legami richiede energia.
Dall’energia di dissociazione dei legami è possibile determinare quali legami chimici sono più forti e quali sono più deboli. L’energia di dissociazione dipende dalla natura degli atomi uniti da un legame o dalla natura della molecola ed è specifica per un singolo legame. Il legame chimico più forte è il legame Si-F.
Energia di legame e energia di dissociazione
Una grandezza strettamente legata al concetto di legame chimico, inteso come interazione specifica tra due atomi A-B è l’energia di legame.
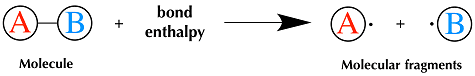 energia di dissociazione
energia di dissociazione
Nel caso di una molecola A-B l’energia di dissociazione corrisponde, cambiata di segno, all’energia di legame. Quanto maggiore è l’energia per dissociare la molecola AB tanto maggiore deve essere l’energia di legame che tiene uniti i due atomi. L’energia di legame è quindi la misura della forza di legame in un legame chimico: rappresenta l’energia che bisogna somministrare a una mole di molecole per suddividerle in singoli atomi.
Quanto maggiore è l’energia per dissociare la molecola AB tanto maggiore deve essere l’energia di legame che tiene uniti i due atomi. L’energia di legame è quindi la misura della forza di legame in un legame chimico: rappresenta l’energia che bisogna somministrare a una mole di molecole per suddividerle in singoli atomi.
 tabella
tabella
Nel caso di molecole poliatomiche è più difficile definire cosa si debba intendere per energia di legame; si consideri, ad esempio, la molecola H2O, nella quale si hanno due legami O-H che possono dissociarsi in due stadi:
H2O → HO + H
HO → O + H
Sebbene i due processi appaiano identici, corrispondendo entrambi alla rottura di un legame O-H le due energie di dissociazione sono diverse. Ciò è dovuto alla diversità tra H2O e HO che sono caratterizzate da distanze O-H diverse e quindi da forze di legame diverse.
Per questo si può definire un’energia di legame media tra due elementi A e B come il rapporto tra l’energia di dissociazione della molecola ABn e il numero n. Così, nel caso della molecola H2O l’energia di dissociazione della molecola, cioè l’energia associata al processo:
H2O → 2 H + O
è di 219 kcal mol-1 e quindi l’energia media del legame OH è di 109.5 kcal mol-1.
Calcolo dell’entalpia
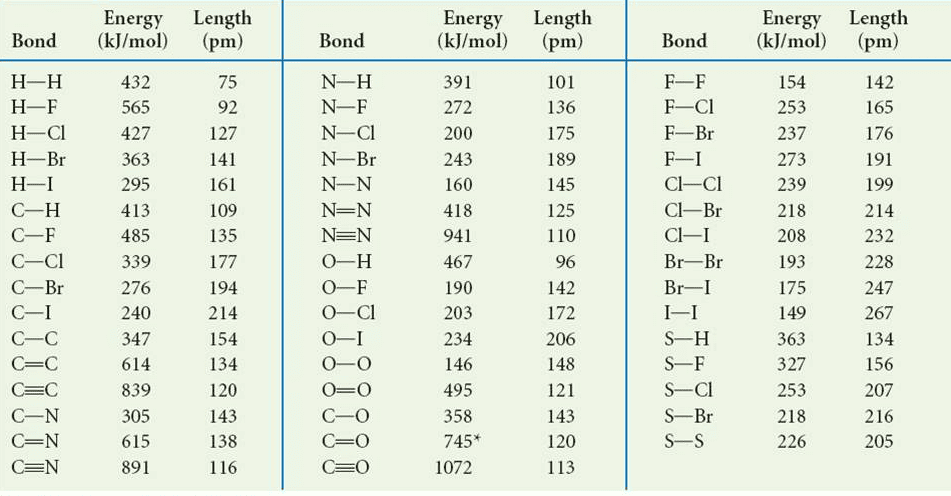
Le energie di dissociazione costituiscono una modalità per stimare la variazione di entalpia di una reazione sebbene vi siano delle limitazioni. Infatti le energie di legame riportate costituiscono solo delle medie. Ad esempio, l’energia di dissociazione relativa a un legame C-H in cui il carbonio è legato a un altro carbonio non è necessariamente uguale a quella in cui lo stesso carbonio è legato a un atomo di azoto o a un atomo di ossigeno.
Inoltre le energie di legame si applicano solo alle variazioni di entalpia delle reazioni in cui sia i reagenti che i prodotti sono in fase gassosa. Se invece sono presenti specie allo stato solido o allo stato liquido è necessario aggiungere o sottrarre i rispettivi calori di fusione, vaporizzazione o sublimazione.
Si consideri la reazione di idrogenazione dell’etene che avviene in fase gassosa:
H2C=CH2 + H2→ CH3CH3
Per calcolare la variazione dell’entalpia utilizzando l’energia di dissociazione ci si avvale della formula:
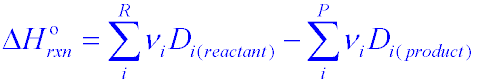 variazione di entalpia
variazione di entalpia
in cui con D si è indicata l’energia di dissociazione e con ν il numero di legami.
Applicando la formula e utilizzando i dati in tabella si ottiene:
ΔH°reazione = (DC=C + 4 DC-H + DH-H) – ( 6 DC-H + DC-C) =
= DC=C + DH-H – DC-C – 2 DC-H = 614 + 432 – 347 – 2 (413) = – 127 kJ/mol
Il valore negativo della variazione di entalpia indica che la reazione è esotermica

