Le ammine alifatiche sono composti organici in cui l’azoto è legato ad almeno un gruppo alchilico. A seconda del numero di gruppi alchilici legati all’azoto, le ammine alifatiche possono essere primarie RNH2, secondarie R2NH e terziarie R3N.
Le ammine alifatiche sono liquidi volatili con odore ammoniacale le cui soluzioni acquose sono alcaline. A causa della presenza del doppietto elettronico solitario presente sull’azoto, le ammine, come l’ammoniaca sono basi secondo Brønsted e Lowry. Tuttavia, a causa della presenza di almeno un gruppo alchilico che è un gruppo elettrondonatore le ammine alifatiche sono più basiche dell’ammoniaca.
Se si considerasse il solo effetto elettrondonatore dei gruppi alchilici che ha un effetto induttivo (+I) ci si dovrebbe aspettare che le ammine terziarie siano le più basiche. In realtà le ammine secondarie hanno basicità maggiore rispetto a quelle primarie e a quelle terziarie pertanto in generale l’ordine di basicità è il seguente:
NH3 < ammine primarie ~ ammine terziarie < ammine secondarie
Per comprendere questo andamento bisogna considerare, oltre all’effetto induttivo altri due fattori ovvero l’impedimento sterico e l’effetto di solvatazione degli ioni. Le dimensioni e il numero di gruppi alchilici legati all’azoto rendono più difficile l’attacco del doppietto elettronico all’idrogeno dell’acqua pertanto le ammine terziarie, pur avendo l’azoto con una maggior densità di carica elettrica hanno un maggior ingombro sterico.
A parità di gruppi alchilici sostituenti le ammine secondarie sono, in generale le più basiche. Infatti vi è la presenza di due gruppi elettrondonatori, ma minore impedimento sterico rispetto alle ammine terziarie. Le ammine primarie sono più basiche dell’ammoniaca ma meno basiche rispetto alle ammine secondarie.
Ammine alifatiche in natura
Le ammine alifatiche si trovano in natura, principalmente come prodotti della putrefazione delle proteine , ma sono presenti anche nei tessuti viventi come, ad esempio, l’istamina che è un’ammina alifatica ciclica. Le metilammine sono presenti in piccole quantità in alcune piante. Molte ammine polifunzionali si trovano come alcaloidi nelle piante, ad esempio la mescalina e le ammine cicliche come nicotina, atropina , morfina e cocaina.
Le ammine alifatiche si trovano nell’atmosfera e sono emesse da una varietà di fonti naturali e antropiche. Le principali fonti antropiche sono l’allevamento di animali e vari processi industriali come l’industria alimentare, chimica e della lavorazione del cuoio.
Le ammine alifatiche vengono utilizzate anche come solventi di assorbimento per la cattura post-combustione della CO2 , mentre anche la combustione, le operazioni di compostaggio e le automobili emettono ammine. Le emissioni naturali includono quelle provenienti dall’oceano, dalla combustione di biomassa, dalla vegetazione e da fonti geologiche come le eruzioni vulcaniche.
Nell’atmosfera, le ammine alifatiche vengono ossidate molto rapidamente dai radicali idrossilici per dare immine, ammoniaca, ammidi, formaldeide, nitroammine, nitrosammine e amminoaldeidi e molti di essi hanno proprietà cancerogene. In misura minore, reagiscono anche con l’ozono.
Sintesi
Le ammine alifatiche possono essere ottenute attraverso diverse vie sintetiche. Le ammine primarie possono essere ottenute tramite una sostituzione nucleofila di alogenuri alchilici per reazione con ammoniaca tramite meccanismo SN2.
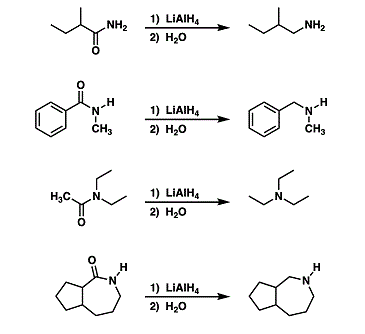 riduzione delle ammidi
riduzione delle ammidi
Un’altra via sintetica prevede l’idrogenazione catalitica o riduzione con idruro metallico di nitrocomposti come, ad esempio, il nitrometano:
CH3NO2 + 3 H2 → CH3NH2 + 2 H2O
Le ammine alifatiche possono essere ottenute dalla riduzione dei nitrili in presenza di litio alluminio idruro:
CH3CH2CH2CN → CH3CH2CH2CH2NH2
o dalle ammidi mediante riduzione, idrolisi o riarrangiamento
Reazioni
L’azoto presente nelle ammine alifatiche può agire non solo come base secondo Brønsted e Lowry ma anche come nucleofilo. Pertanto le ammine alifatiche possono reagire con una varietà di elettrofili. Le ammine possono essere ossidate da agenti ossidanti come permanganato di potassio, ozono, perossido di idrogeno per dare le aldeidi come prodotto di reazione.
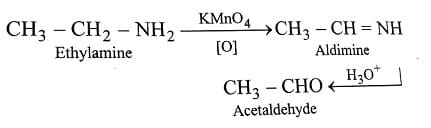 ossidazione delle ammine
ossidazione delle ammine
Le reazioni delle ammine con un alogenuro alchilico, in cui avviene la rottura del legame carbonio-alogeno portano all’aggiunta del gruppo alchilico all’azoto. Nella reazione di alchilazione delle ammine, il gruppo amminico nucleofilo dell’ammina attacca il carbonio del gruppo alchilico e avviene la formazione di un legame covalente tra il gruppo amminico e il gruppo alchilico.
Quando l’ammina primaria reagisce con l’aloalcano, si forma l’ammina secondaria. L’ammina secondaria reagisce con l’aloalcano per formare l’ammina terziaria. Quando l’ammina terziaria reagisce con l’aloalcano, produce sale di ammonio quaternario.
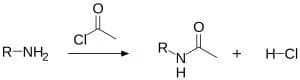 acilazione delle ammine
acilazione delle ammine
Le ammine alifatiche sia primarie e secondarie reagiscono con cloruri acilici o anidridi e i prodotti di reazione sono delle ammidi in quanto avviene una N-acilazione.
Le reazioni delle ammine con un gruppo acilico avviene secondo un meccanismo di sostituzione nucleofila. La reazione viene condotta in presenza di una base più forte dell’ammina, come la piridina.
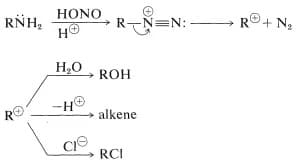 Reazione con acido nitroso
Reazione con acido nitroso
Le ammine primarie alifatiche reagiscono con l’acido nitroso danno luogo alla formazione di sali di diazonio alifatici instabili che perdono azoto molecolare per formare un carbocatione.
Questo, a sua volta, può dare tutte le reazioni tipiche dei carbocationi come addizione di acqua per formare un alcol, perdita di H + per formare un alchene oppure riarrangiamenti per dare un carbocatione che, a sua volta, può dare un alcol o un alchene. Dal punto di vista sintetico, tale reazione non è utilizzata perché produce miscele di prodotti
Dalla reazione tra un’ammina secondaria e acido nitroso si ha la formazione di N-nitrosammine che sono di colore giallo e di natura oleosa. Le reazioni delle ammine primarie con i composti contenenti un gruppo carbonilico danno luogo formazione di immine. Nello specifico, le aldeidi diventano aldimmine e i chetoni diventano chetimmine.
Le ammine secondarie reagiscono con chetoni e aldeidi per formare enammine.
Usi
Le ammine alifatiche sono usate come elementi costitutivi in diversi campi, tra cui la sintesi di polimeri, coloranti, pigmenti, agenti plastificanti e utilizzate anche in campo farmaceutico, come tensioattivi nei detergenti e nei prodotti cosmetici.
In Breaking Bad, la metilammina viene utilizzata da Walter White e Jesse Pinkman poiché utilizzano l’amminazione riduttiva del fenilacetone per produrre metanfetamine, un processo ideato per eludere la necessità di acquistare pseudoefedrina.
La metilammina è uno dei composti che contribuiscono alla rimozione dei componenti acidi del gas naturale ed inoltre è ampiamente utilizzata nell’industria farmaceutica per produrre anticonvulsivanti, analgesici con effetti antispastici e sedativi, antidepressivi, rilassanti muscolari, tranquillanti e mezzi di contrasto per raggi X.
La metilammina, unitamente alla dimetil e alla trimetilammina sono utilizzate come componenti negli additivi per carburanti per benzina, olio motore, carburante per aerei, liquidi refrigeranti per motori ad alta velocità e come propellente per razzi.

