I complessi dei metalli di transizione con gli alcheni sono composti di coordinazione che includono uno o più alcheni come leganti. Essi svolgono un ruolo di intermediazione in molte reazioni catalitiche che convertono gli alcheni in diversi prodotti organici.
Per spiegare il legame dei complessi degli alcheni con i metalli di transizione ci si avvale del modello di Dewar-Chat-Duncanson dovuto al chimico statunitense Michael James Steuart Dewar, al chimico britannico Joseph Chatt e a L. A. Duncanson.
Il legame nei complessi degli alcheni è spesso rappresentato utilizzando il formalismo dell’apticità. Questo legame si forma tra gli elettroni π degli alcheni, che agiscono come leganti, e il metallo di transizione.
Si tratta di un processo sinergico che coinvolge una donazione di elettroni dall’orbitale π pieno del legante all’orbitale d vuoto del metallo. Allo stesso tempo, avviene una retrodonazione degli elettroni dall’orbitale d all’orbitale π* non occupato del legante.
Modello Dewar-Chat-Duncanson
Secondo questo modello, che spiega il legame nei complessi degli alcheni, i due effetti della donazione e retrodonazione di elettroni tendono a diminuire la forza del legame Carbonio-Carbonio. Ciò comporta un aumento della distanza tra i due atomi di carbonio e una riduzione della loro frequenza di vibrazione.
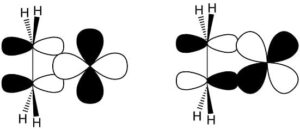
L’interazione descritta provoca una riorganizzazione degli atomi di carbonio da sp2 a sp3, che a sua volta provoca una dispersione degli atomi di idrogeno lontano dal metallo. Più elevata è la densità elettronica retrodonata nell’orbitale π* dell’alchene, maggiore sarà la riduzione dell’ordine del legame C=C.
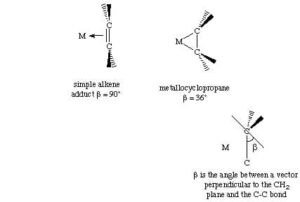
Un’alternativa per esprimere questo concetto è affermare che l’ibridazione del carbonio dell’alchene passa da sp2 a sp3 all’aumentare della retrodonazione. Entrambi i modelli descrivono due strutture limite: un addotto olefinico planare e un metallociclopropano. Gli studi cristallografici a raggi X confermano che, al crescere della lunghezza del legame carbonio-carbonio, il piano CH2 viene distorto rispetto alla geometria planare ideale di un alchene.
I fattori elettronici svolgono un ruolo importante nell’interazione tra alcheni e metalli di transizione. Ad esempio, il tetrafluoroetilene si lega più saldamente rispetto all’etilene a un complesso metallico a bassa valenza a causa dei gruppi elettronattrattori presenti sull’olefina, che comportano una minore donazione σ e un abbassamento dell’energia dell’orbitale π*.
Allo stesso modo, l’etilene non è un buon legante per i complessi metallici d0 in quanto non possiede elettroni d che possono essere retrodonati. La stabilità dei complessi degli alcheni dipende anche da fattori sterici, con la stabilità relativa seguente ordine: tetrasostituito < trisostituito < trans-disostituito < cis-disostituito < monosostituito < etilene.
Sintesi dei complessi degli alcheni
Esistono diverse strade sintetiche per ottenere i complessi degli alcheni, come ad esempio la sostituzione dei leganti. Un metodo comune consiste nella reazione tra il tetracloroplatinato (II) di potassio e l’etene, che produce il Tricloro(η2-etene)platinato(II) di potassio, anche conosciuto come sale di Zeise.
Il sale di Zeise è stato il primo composto organometallico contenente un legante insaturo. William Christopher Zeise, professore all’Università di Copenaghen lo sintetizzò per la prima volta nel 1827, mentre studiava la reazione del tetracloruro di platino con etanolo bollente, e propose che il composto ottenuto contenesse etilene.
Un metodo alternativo implica la riduzione di un metallo con un alto numero di ossidazione utilizzando un alchene o mediante un processo di eliminazione riduttiva per rimuovere un atomo di idrogeno. Gli alcheni con gruppi elettronattrattori tendono ad avere una forte affinità con i metalli a basso stato di ossidazione. Alcuni esempi di questi leganti includono il tetracianoetilene, il tetrafluoroetilene, l’anidride maleica e gli esteri dell’acido fumarico.
Reazioni dei complessi degli alcheni
Il legame di un alchene ad un metallo di transizione può attivare il legante verso un attacco elettrofilo o nucleofilo a seconda della natura e della carica del centro metallico. Ad esempio, se c’è un’elevata carica formale sul centro del metallo, l’olefina è soggetta ad attacco da parte dei nucleofili sulla faccia opposta al metallo dando un’addizione in trans. Allo stesso modo, i centri metallici ricchi di elettroni negli stati di bassa ossidazione vengono attivati per l’attacco da parte degli elettrofili sul legame C-C.
Esempi di complessi degli alcheni
Oltre al sale di Zeise, tra i complessi degli alcheni più noti vi è il catalizzatore di Crabtree ottenuto dal chimico britannico Robert Howard Crabtree. Questo complesso è un composto
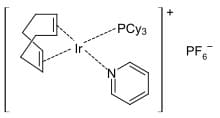
organico dell’iridio ed è usato come catalizzatore omogeneo nelle reazioni di idrogenazione. Ha formula [C8H12IrP(C6H11)3C5H5N]PF6 ed ha geometria molecolare quadrato planare.
Tra i complessi degli alcheni vi è un composto organico del rodio ovvero il dimero di clorobis(cicloottene)rodio che ha formula Rh2Cl2(C8H14)4, utilizzato quale catalizzatore e quale precursore di composti organici del rodio.
Il bis(cicloottatetraene)ferro è un composto organico del ferro con formula Fe(C8H8)2 nella cui struttura due anelli di cicloottatetraene si legano in modo diverso al ferro. Un anello di cicloottatetraene si lega al Fe con due doppi legami adiacenti mentre il secondo anello di cicloottatetraene si lega attraverso tre doppi legami.
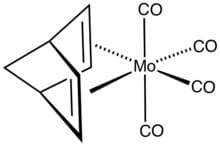
Il (Norbornadiene)molibdeno tetracarbonile è un altro dei complessi degli alcheni che ha formula (C7H9)Mo(CO)4 ed è un composto organico del molibdeno. È costituito dall’idrocarburo biciclico norborene legato al molibdeno tetracarbonile.

