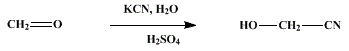Il gliconitrile il cui nome I.U.P.A.C. è 2-idrossiacetonitrile è una cianidrina derivante dalla formaldeide avente formula HOCH2CN.
Il gliconitrile è un liquido oleoso incolore e inodore dal sapore dolciastro, solubile in acqua e in etere che tende a decomporsi in formaldeide e cianuro di idrogeno secondo la reazione:
HOCH2CN → HCHO + HCN
Sintesi
Può essere ottenuto dalla reazione tra formaldeide e cianuro di potassio a cui viene aggiunto acido solforico:
Reazioni
Il gliconitrile reagisce con l’ammoniaca per dare l’amminoacetonitrile secondo la reazione:
HOCH2CN + NH3 → H2NCH2CN + H2O
L’amminoacetonitrile contiene due gruppi funzionali ovvero il gruppo amminico e il gruppo nitrile pertanto è utilizzato nella sintesi di eterocicli contenenti azoto.
Dall’idrolisi dell’amminoacetonitrile si ottiene la glicina:
H2NCH2CN + 2 H2O → H2NCH2COOH + NH3
Viene utilizzato quale intermedio nella produzione di farmaci, come componente di resine sintetiche e come solvente.
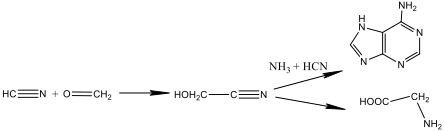
Il gliconitrile è assurto agli onori della cronaca agli inizi del 2019 grazie agli studi grazie agli studi di un team di ricercatori londinesi che hanno individuato la molecola di gliconitrile nello spazio.
L’importanza di tale scoperta è dovuta al fatto che il gliconitrile è considerato una molecola prebiotica precursore chiave per la formazione della base azotata adenina che si trova sia nel DNA che nell’RNA di organismi viventi
Usi
Il gliconitrile è utilizzato:
- nella produzione di intermedi nella produzione farmaceutica
- come componente di resine sintetiche
- come intermedio chimico per composti organici