Lo ione solfuro S2- è presente in molti minerali tra cui la galena PbS, la calcocite Cu2S, la millerite NiS, la sfalerite FeS e ZnS e il cinabro HgS.
Il solfuro forma sali molti dei quali poco solubili con i metalli ma si trova legato a gruppi alchilici formando composti organici come i tioeteri e i tioli noti come mercaptani.
Un esempio di tioetere è il dimetilsolfuro CH3SCH3 mentre un esempio di tiolo è l’etantiolo CH3CH3SH.
Solubilità
Una soluzione acquosa di un solfuro solubile contiene una bassissima quantità di ione solfuro a causa della sua idrolisi secondo l’equilibrio:
S2-+ H2O ⇄ HS– + OH–
La costante Kb2 è piuttosto alta essendo pari a Kw/Ka2 = 10-14/1.3 · 10-13 = 0.077 e ciò implica che l’equilibrio è spostato a destra. Le soluzioni contenenti lo ione solfuro caratterizzate dal tipico odore di uova marce sono quindi basiche.
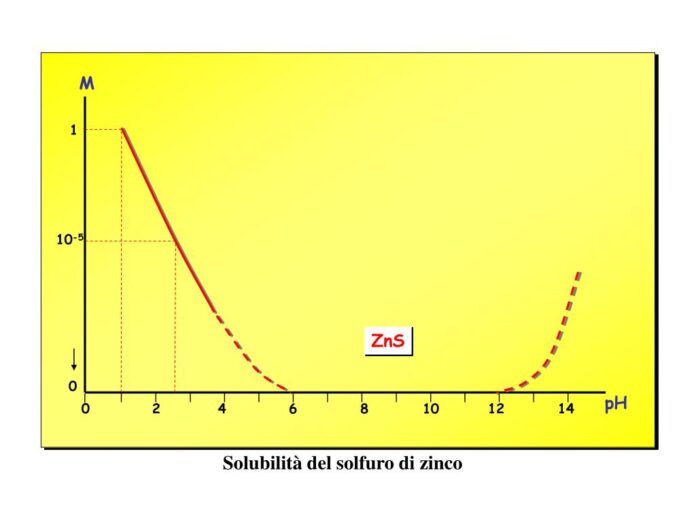
La solubilità dei solfuri metallici poco solubili è influenzata dal pH infatti aumenta al diminuire del pH ovvero all’aumentare della concentrazione dello ione H+.
I solfuri sono presenti nell’ambiente a causa di processi naturali e industriali. In natura il solfuro di idrogeno H2S si forma per decomposizione delle proteine contenenti zolfo ad opera dei solfobatteri e quindi si trova nei gas di palude, nel petrolio, nel gas naturale e nei sistemi di raccolta delle acque reflue.
Le fonti artificiali di H2S sono costituite da processi di raffinamento di materiali naturali contenenti zolfo.
Le acque reflue contenenti una quantità di solfuro maggiore di 1 mg/L devono essere purificate prima di poter essere rilasciate nell’ambiente.
Il solfuro deve quindi essere ossidato o a zolfo elementare o a ione solfato utilizzando, ad esempio, perossido di idrogeno.
Ossidazione
A seconda del pH della soluzione l’ossidazione del solfuro con perossido di idrogeno segue due strade diverse:
- In ambiente neutro o debolmente acido si forma zolfo elementare che si presenta sotto forma colloidale ed è di colore bianco se l’ossidazione è stata completa mentre è di colore giallo in caso di ossidazione incompleta:
H2S + H2O2 → S + 2 H2O
Lo zolfo può essere rimosso per flocculazione con un polimero anionico seguita da filtrazione
- In ambiente alcalino per valori di pH maggiori di 9.2 si forma lo ione solfato:
S2- +4 H2O2 → SO42- + 4 H2O
- Per valori di pH tra 7 e 9 si può formare sia lo zolfo elementare che il solfato. A seconda delle necessità si possono utilizzare catalizzatori come nichel e per ottenere lo zolfo mentre ferro, rame e manganese favoriscono la formazione del solfato.