Il tiosolfato di sodio è un composto inorganico avente formula Na2S2O3 che si presenta idrato e pertanto viene scritto genericamente come Na2S2O3· x H2O sebbene sia in genere disponibile come pentaidrato Na2S2O3· 5 H2O.
E’ un solido cristallino bianco solubile in acqua si dissocia in 2 Na+ e S2O32- e poco solubile in etanolo con un punto di fusione di 48.3°C.
E’ un composto stabile ma, a seguito di riscaldamento, si decompone in solfato di sodio e pentasolfuro di sodio secondo la reazione:
4 Na2S2O3 → 3 Na2SO4 + Na2S5
La struttura del tiosolfato di sodio è rappresentata in figura:
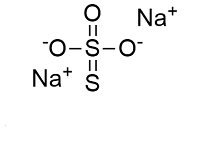
un atomo di zolfo centrale è legato a un altro atomo di zolfo tramite doppio legame, a un atomo di ossigeno tramite doppio legame e a due atomi di ossigeno tramite legame semplice. Pertanto i due atomi di zolfo presenti hanno due diversi numeri di ossidazione: l’atomo di zolfo centrale ha numero di ossidazione + 6 mentre l’altro atomo di zolfo ha numero di ossidazione zero.
Sintesi
Uno dei metodi di sintesi del tiosolfato di sodio prevede la reazione tra zolfo e idrossido di sodio:
4 S + 6 NaOH → Na2S2O3 + 2 Na2S + 3 H2O
Un altro metodo prevede l’ottenimento del tiosolfato di sodio tramite tre reazioni:
- Nella prima reazione viene fatto reagire con carbonato di sodio, biossido di zolfo e acqua per dare idrogenosolfito di sodio e biossido di carbonio:
Na2CO3 + 2 SO2 + H2O → 2 NaHSO3 + CO2
- Nella seconda reazione l’idrogeno solfito di sodio reagisce ulteriormente con il carbonato di sodio per dare solfito di sodio, biossido di carbonio e acqua:
2 NaHSO3 + Na2CO3 → 2 Na2SO3 + CO2 + H2O
- Nella terza reazione il solfito di sodio viene fatto reagire con lo zolfo secondo la reazione di comproporzione:
Na2SO3 + S → Na2S2O3
Reazioni
Il tiosolfato di sodio reagisce con acido cloridrico per dare zolfo e biossido di zolfo secondo la reazione:
Na2SO3 + 2 HCl → 2 NaCl + S + SO2 + H2O
Reagisce quantitativamente con lo iodio per dare tetrationato e ioduro secondo la reazione:
2 Na2S2O3 + I2 +→ Na2S4O6 + 2 NaI
In presenza di acido solforico il tiosolfato di sodio reagisce per dare solfato di sodio, biossido di zolfo e zolfo:
Na2S2O3 + H2SO4 → Na2SO4 + SO2 + S + H2O
Usi
Viene utilizzato, dopo essere stato standardizzato con bicromato di potassio nelle titolazioni iodometriche.tiosolfato di sodio viene utilizzato in campo medico nel trattamento di intossicazione da cianuro.
Viene utilizzato nei processi fotografici in quanto è capace di legarsi con AgBr formando un complesso solubile che viene portato via attraverso numerosi lavaggi della pellicola.
AgBr (solido, insolubile) + 2 S2O32- → Ag(S2O3)23- (complesso solubile) + Br–
In ambiente basico reagisce con l’ipoclorito di sodio per dare cloruro di sodio e solfato di sodio secondo la reazione:
Na2S2O3 + 4 NaClO +2 NaOH → 4 NaCl +2 Na2SO4 + H2O
Grazie a questa reazione il tiosolfato di sodio viene utilizzato per allontanare l’eccesso di ipoclorito presente nelle acque.

